Publié le 10 mar 2008Lecture 11 min
Fièvres récurrentes : quand penser à une maladie auto-inflammatoire ?
I. KONÉ-PAUT, Hôpital de Bicêtre AP-HP, Le Kremlin-Bicêtre
Le diagnostic des fièvres récurrentes pose bien des difficultés du fait de la diversité des étiologies possibles et du peu d’outils biologiques spécifiques. Un certain nombre de ces épisodes fébriles sont dus à des déficits de l’immunité innée, et il faut savoir reconnaître.
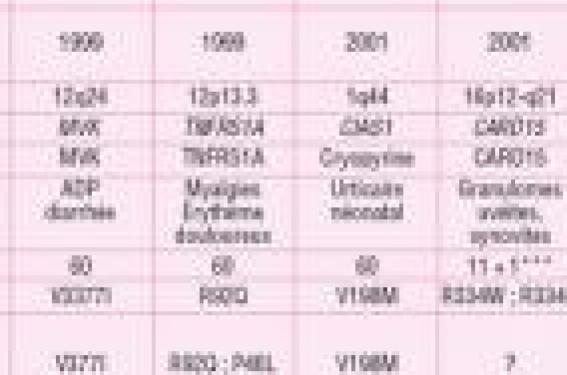
Un concept nouveau : les maladies auto-inflammatoires Les fièvres récurrentes héréditaires (FRH) sont caractérisées par des poussées inflammatoires survenant sans facteur déclenchant apparent. Leurs caractéristiques cliniques communes associent à la fièvre, des manifestations digestives, cutanées, articulaires et parfois oculaires. Au cours des poussées des FRH, un syndrome inflammatoire biologique est présent et les tissus atteints sont infiltrés de polynucléaires neutrophiles. L’essentiel de ces maladies comporte un dérèglement du système immunitaire mettant en jeu les monocytes et les neutrophiles et ne s’accompagne d’aucun titre élevé d’auto-anticorps ou de lymphocytes activés spécifiquement par un antigène. Il inclut également dans certains cas une sensibilité accrue à la détection de certains composants des parois bactériennes appelés PAMPs (Pathogen Associated Molecular Patterns) venant activer des récepteurs TLRS (Toll-like receptor) et des protéines. Les fièvres récurrentes héréditaires sont caractérisées par des poussées inflammatoires survenant sans facteur déclenchant apparent. Les responsabilités génétiques identifiées À ce jour 6 gènes ont été identifiés comme responsables de huit maladies auto-inflammatoires héréditaires (tableau). Le premier, reconnu en 1997, est MEFV (MEditerranean FeVer), responsable de la fièvre méditerranéenne familiale (FMF). Deux gènes ont été identifiés en 1999, le gène MVK (MeValonate Kinase) impliqué dans le syndrome hyper IgD (ou déficit en mévalonate kinase : MKD) et le gène TNFR responsable du syndrome TRAPS (TNF Receptor Associated Periodic Syndrome). En 2001, le gène CIAS1 (Cold Induced Associated Syndrome) a été reconnu responsable de trois syndromes de gravité croissante : l’urticaire familiale au froid (UFF), le syndrome de Muckle et Wells (SMW) et le syndrome CINCA (syndrome chronique infantile neurologique, cutané et articulaire). Deux autres gènes CARD15 et PISTPIP1 (CD2BP1) sont respectivement responsables de deux entités très rares, le syndrome de Blau (ou forme familiale de granulomatose systémique à début précoce) et le syndrome PAPA (Pyogenic Acne Pyodermagangrenosum and Arthritis). Le groupe des maladies auto-inflammatoires (MAI) s’élargit progressivement à des maladies non clairement héréditaires telles que le syndrome de Marshall, l’arthrite juvénile systémique, la maladie de Behçet ou encore la goutte (figure 1). Certaines pathologies apparemment auto-immunes comme le vitiligo associé à une auto-immunité familiale pourraient faire intervenir des gènes auto-inflammatoires. Quand penser à une maladie auto-inflammatoire ? Les signes cliniques d’alerte Une MAI peut être évoquée devant des épisodes fébriles récurrents, non expliqués clai-rement par une infection et s’accompagnant d’un syndrome inflammatoire biologique. Nous n’aborderons ici que les MAI plus « classiques ». Un syndrome aisément reconnaissable, le PFAPA ou syndrome de Marshall Le syndrome PFAPA est particulier du fait de la régularité des épisodes fébriles au point qu’ils sont prévisibles par les parents. Ils durent entre 5 et 7 jours, s’accompagnant typiquement d’une pharyngite (exsudative ou non), d’adénopathies cervicales sensibles et d’aphtes buccaux. Il touche de très jeunes enfants autour de 2 ans, avec une légère prédominance masculine. Les signes sont très sensibles à une dose unique de cortisone. L’amygdalectomie éradique le syndrome dans plus de 90 % des cas. Des épisodes identiques ou des antécédents d’amygdalectomie sont parfois retrouvés dans la famille. La fièvre méditerranéenne familiale, le « prototype » des MAI La FMF est une maladie génétique autosomique récessive répandue dans certaines populations, particulièrement chez les Arméniens et les juifs d’Afrique du Nord. Elle doit être évoquée dans ce contexte, devant des crises fébriles, sans périodicité particulière, durant typiquement 48 à 72 heures, précédées de frissons et de prodromes à type d’irritabilité, douleurs pharyngées, douleurs des membres ou troubles gastro-intestinaux. Certains signes cutanés sont très évocateurs du diagnostic, en particulier les plaques érysipélatoïdes (figure 2). Certains patients présentent des œdèmes épisodiques unilatéraux des mollets faisant porter parfois à tort le diagnostic de phlébite. Les myalgies sont très fréquentes, souvent induites par l’endurance. Les arthrites touchent plus volontiers la cheville et le genou, elles ont un aspect très inflammatoire mais durent rarement au-delà de 15 jours. Le traitement préventif des crises et de l’amylose secondaire repose sur la prise orale de colchicine au long cours. Les syndromes périodiques associés à CIAS1 ou CAPS Ce spectre clinique regroupe trois entités, l’urticaire familiale au froid (UFF), le syndrome de Muckle et Wells (SMW) (figure 3) et le syndrome CINCA. Elles comportent toutes des manifestations urticariennes infiltrées de polynucléaires neutrophiles dont le début est néonatal pour le SMW et le CINCA. Au cours de l’UFF, l’urticaire survient avant l’âge de 6 mois, 1 à 2 h après exposition au froid. Elle s’accompagne de fièvre, d’arthralgies et parfois de conjonctivite. L’urticaire est quasi permanente au cours du SMW, s’accompagne d’une petite fièvre, se complique dans l’adolescence d’une surdité neurosensorielle et parfois dans son évolution, d’une insuffisance rénale par amylose secondaire. En plus des manifestations présentes dans les autres syndromes, le syndrome CINCA compte une atteinte neurosensorielle sévère avec méningite chronique, retard mental, uvéite, œdème papillaire et névrite optique. Les atteintes articulaires sont très particulières, pouvant comporter une hypertrophie pseudo-tumorale des cartilages de croissance (figure 4). Les manifestations cliniques répondent aux traitements par anti-IL1 (en cours de validation). De Gauche à droite figure 2 à 4. Figure 2. Plaques érysipélatoïdes de la fièvre méditerranéenne familiale. Figure 3. Syndrome de Muckle et Wells. Figure 4. Syndrome CINCA. Le syndrome TRAPS Ce syndrome de transmission autosomique dominante a été initialement décrit sous le nom de fièvre hibernienne familiale. Il comporte sur le plan clinique l’association d’une fièvre récurrente apparaissant dans l’enfance, pouvant durer plusieurs semaines, s’accompagnant de douleurs abdominales parfois thoraciques et scrotales intenses. Les myalgies localisées au tronc et aux membres sont associées à des plaques érythémateuses de « pseudo-cellulites » infiltrées de polynucléaires neutrophiles. Sa complication principale est l’amylose secondaire de type AA. La corticothérapie est efficace à haute dose. Les traitements plus modernes reposent sur le récepteur p75 du TNF (etanercept) et les anti-IL1. Le syndrome MKD Ce syndrome très rare, de transmission récessive autosomique, est caractérisé par une fièvre récurrente élevée avec frissons, apparaissant dans les premiers mois de vie, durant environ 1 semaine, et des crises douloureuses abdominales accompagnées de vomissements et d’arthrites fugaces. Des éruptions diverses sont décrites, maculopapuleuses, urticariennes, voire un érythème noueux. La présence de céphalées intenses, d’hypertrophie ganglionnaire, d’une splénomégalie et de réactions fébriles et cutanées intenses après les vaccinations, sont très évocatrices de la maladie. Dans sa forme complète, le syndrome MKD réalise un tableau métabolique prédominant associant une dysmorphie, un retard mental, une cataracte, une ataxie cérebelleuse et une hépatosplénomégalie. Le diagnostic biochimique est possible par le dosage de l’acide mévalonique dans les urines lors d’une poussée fébrile. La colchicine est inefficace. Certains patients répondent aux anti-IL1. Physiopathologie des maladies auto-inflammatoires Fièvre méditerranéenne familiale Le gène causal de la FMF, MEFV est localisé sur le bras court du chromosome 16, en 16p13.3. Il convient de noter que tous les variants du gène n’ont pas le même effet sur le tableau clinique des patients. La pyrine, protéine « prototype » codée par le gène MEFV, est ex-primée dans les leucocytes et les monocytes. Elle intervient dans ces cellules sur trois voies physiologiques assez reliées que sont l’apoptose, la sécrétion de cytokines et la régulation du cytosquelette. L’inflammasome est un complexe ternaire comprenant une protéine à domaine PYD, ASC et la procaspase 1, dont l’oligomérisation sous l’effet d’un stimulus de type PAMPs par exemple, provoque la maturation de l’IL1b, un puissant pyrogène (figure 5). Figure 5. Théorie pro-inflammatoire de la protéine responsable de la fièvre méditerranéenne familiale. Même si le lien entre les mutations du gène MEFV et la FMF ne fait aucun doute, le rôle direct de celles-ci sur les conséquences fonctionnelles de la pyrine, reste encore à démontrer. Les mutations dans MEFV auraient un effet gain de fonction acquis durant l’évolution pour détecter un spectre plus large de PAMPs que la protéine sauvage. Une meilleure réponse immuno-logique aux pathogènes pourrait conférer un avantage sélectif aux porteurs de mutations, hypothèse étayée par l’observation d’une prévalence particulièrement élevée des hétérozygotes dans les populations méditerranéennes. Syndromes CAPS Les CAPS (Cold Autoimmum Periodic Syndromes) sont liés à des mutations dominantes du gène CIAS1 qui code pour la protéine NALP3 ou cryopyrine. Cette protéine intervient sur la même voie d’activation de l’inflammation que la pyrine, mais elle y joue un rôle d’induction (contrôle positif). Quand la cryopyrine est mutée, il se produit une stimulation excessive de la caspase 1, activant la transformation de la pro-IL1b en IL1b active qui sera sécrétée. Cela aboutit aussi à une inhibition de l’apoptose des cellules myéloïdes et des chondrocytes (dans lesquels la cryopyrine est aussi exprimée). Cette anomalie des chondrocytes pourrait expliquer les arthralgies, la surdité et les phénomènes d’ossification précoce de la rotule et des os longs des patients atteints de syndromes CAPS. Syndrome TRAPS Le TRAPS est la conséquence de mutations affectant le récepteur soluble P55 du TNF, le TNFRSF1A, un régulateur essentiel de l’inflammation. En situation physiologique, le TNFa active le TNFRSF1A et produit son détachement de la surface des monocytes. Ce récepteur libre peut lier le TNFa et limiter son activité inflammatoire et apoptotique. Au cours du TRAPS, les mutations situées dans le domaine extracellulaire du TNFRSF1A peuvent altérer le clivage du TNF membranaire, surtout si elles affectent la structure tridimensionnelle de cette molécule. Syndrome MKD La mévalonate kinase (MVK), enzyme déficiente des MKD, est une protéine à activité enzymatique située sur la voie de synthèse du cholestérol et des isoprénoïdes. Un déficit complet (< 0,5 % ; acidurie mévalonique, AM) ou partiel (1-10 % : syndrome hyper IgD, HIDS) de l’activité enzymatique de la MVK aboutit à une acidurie mévalonique et à une carence en isoprénoïdes. Les épisodes inflammatoires des patients ayant une MKD sont probablement liés à une carence en isoprénoïdes, dont le flux est régulé par l’activité de la mévalonate kinase. Quand et où demander un test génétique ? Dans une situation claire, par exemple avec des signes typiques de FMF, dans une population à risque, le test génétique peut être demandé pour confirmer le diagnostic. Il sera contributif si deux mutations sont retrouvées, une sur chaque chromosome, ce qui est le cas dans 70 % des formes typiques. Dans les autres cas, une seule ou aucune mutation retrouvée, c’est le diagnostic clinique qui prévaut, et il est recommandé d’effectuer un test thérapeutique par la colchicine. Dans les situations moins claires, ces examens restent coûteux et délicats d’interpré-tation. Il est alors recommandé de prendre un avis d’expert pour guider la demande vers le gène le plus probablement en cause (figure 6). Figure 6. Le test génétique des Fièvres récurrentes héréditaires, arbre décisionnel (d’après Federici L et al. Ann Rheum Dis 2006 ; 65 : 1427-32). Trois laboratoires publiques de génétique effectuent ces recherches en France : – Montpellier (I. Touitou) ; – Paris-Cochin (L. Cuisset, C. Dodé) ; – Paris-Trousseau (S. Amsellem). Les résultats sont remis sous pli confidentiel au médecin demandeur qui doit les rendre aux familles avec leur interprétation, de préférence avec l’avis d’un expert. Dans les situations moins claires, il est recommandé de prendre l’avis d’un expert pour guider l’exploration génétique. Pour la pratique, on retiendra Les maladies auto-inflammatoires, un concept nouveau fondé sur : • une prédisposition génétique à produire de l’inflammation sans raison apparente ; • des manifestations intermittentes, se ressemblant entre les différentes maladies ; • un même circuit de déclenchement de l’inflammation impliqué à des étapes différentes ; • un dérèglement du système immunitaire mettant en jeu les monocytes et les leucocytes ; • l’absence d’auto-anticorps (immunité innée).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


