Publié le 26 sep 2006Lecture 27 min
Neuro-Imagerie des démences
A. ABANOU, J.-L. STIEVENART, C. HABAS, L. BELLINGER, A. ISTOC, M.-T. IBA-ZIZEN, E.- A. CABANIS Université Pierre et Marie Curie Paris 6, UFR Pierre et Marie Curie Site Pitié-Salpêtrière, Service de Neuro-Imagerie, Centre Hospitalier National d’Ophtalmolo
L’incidence clinique annuelle de la maladie d’Alzheimer (MA) (150 000 patients des deux sexes selon Bruno Dubois) résume le décalage existant entre la maladie et nos capacités à y faire face. Puisque la précocité du diagnostic contribue à la prévention de la maladie par sa meilleure compréhension et par sa meilleure prise en charge, les auteurs proposent que, malgré un développement encore lent, l’imagerie par résonance magnétique (IRM) multimodalité vienne s’imposer, à côté du protocole connu.
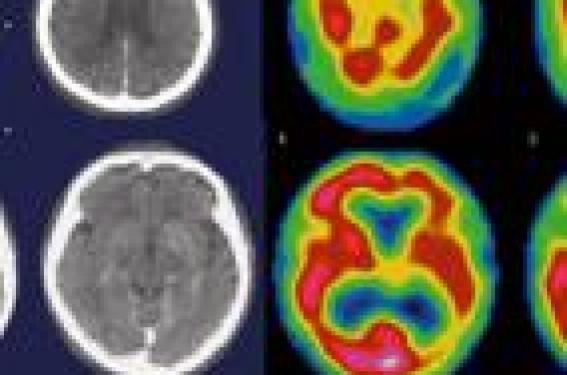
La démence se définit comme une détérioration mentale acquise, chronique, progressive et irréversible. Les démences sont devenues un problème de santé publique avec l’accroissement de l’espérance de vie et le vieillissement de la population. Si dans la réalité quotidienne, le terme de démence nous fait penser à une maladie d’Alzheimer (MA), il faut savoir que la plupart des affections du système nerveux central peuvent évoluer vers une démence. La neuro-imagerie avec le scanner à rayons X et, essentiellement l’imagerie par résonance magnétique (IRM) vont se trouver au centre de la prise en charge de ces patients. Autrefois cette imagerie était demandée tardivement. Elle servait essentiellement de conforter ou confirmer une suspicion clinique et à éliminer des causes organiques de démence. La sémiologie était pauvre et se contentait souvent de décrire l’atrophie. L’absence de marqueur diagnostique in vivo, l’apparition de traitements spécifiques incite à affiner la sémiologie en neuro-imagerie. L’IRM, grâce aux techniques conventionnelles couplées aux méthodes structurales et connectives, apprécie la forme et la fonction, permettant aujourd’hui d’évoquer les diagnostics, d’évaluer le pronostic. Ces techniques de choix dans l’exploration des patients à risque sont à intégrer dans les essais thérapeutiques (Figures 1 à 3). Figure 1. Aphasie progressive chez un homme dans sa 6e décade (1994). Neuro-imagerie classique : scan RX à gauche et scintigraphie à l’HMPAO à droite. Coupes axiales. Atrophie corticale visible en scan RX. En scintigraphie : baisse de la perfusion du cortex hémisphérique gauche. Figure 2. Même patient, deux ans plus tard (1996). Aggravation clinique. Scintigraphie à l’HMPAO. Coupes axiales successives. Hypoperfusion hémisphérique gauche aggravée avec apparition d’une hypoperfusion hémisphérique droite. Figure 3. Même patient, quatre ans plus tard (1998). Évolution clinique vers une démence caractérisée. Scintigraphie à l’HMPAO. Coupes axiales successives. Aggravation de l’hypoperfusion hémisphérique bilatérale. Les techniques et séquences de neuro-imagerie L’IRM est la technique de choix dans l’exploration des démences. L’indication du scanner RX équivaut aujourd’hui à la contre-indication de l’IRM. Les contre-indications de l’IRM sont bien répertoriées. La coopération des patients est plus que nécessaire. L’absence de coopération et les artéfacts de mouvement qui en résultent peuvent rendre les explorations IRM inutilisables. La neuro-imagerie moderne fait appel à deux grands concepts : • les techniques morphologiques • et les techniques structurales. Les techniques morphologiques Elles reproduisent une anatomie macroscopique in vivo. Elles nécessitent une technologie de gradients magnétiques et de logiciels de calcul de l’image de puissance moyenne. Les séquences d’écho de spin et d’écho de gradient T1, T2, en coupes fines sont réalisées dans différents plans de l’espace : axial-oblique des voies visuelles ou plan neuro-oculaire (PNO), alignant la commissure antérieure (Ca) aux corps mamillaires ou plan Ca-Cm. Ces différents plans et pondérations permettent d’apprécier de façon exhaustive l’anatomie et les modifications du signal des différentes structures impliquées dans la pathogénie des démences. La séquence FLAIR (Fluid Attenuation Inversion Recovery) en inversant le signal du liquide cérébro-spinal détecte les lésions périventriculaires mais surtout les lésions corticales et sous-corticales. Les lésions en hypersignal T2, hyposignal T1 sont facilement détectables à l’étage supratentoriel grâce, en particulier, à la séquence FLAIR. Cette dernière est souvent mise en défaut dans les localisations de la fosse postérieure où son rendement diagnostique est faible. La séquence en pondération T2* est nécessaire pour mettre en évidence tout effet de susceptibilité magnétique dû en particulier à un dépôt d’hémosidérine ou à des calcifications. L’angiographie par résonance magnétique (ARM) repose sur trois principes : - le temps de vol ou time of flight ; - le contraste de phase ; - l’ARM avec gadolinium. L’injection d’un produit de contraste paramagnétique, le gadolinium, rend compte de l’ouverture et de la perméabilisation de la barrière hémato-encéphalique. Le gadolinium sera alors à l’origine d’un raccourcissement du T1 dont la traduction est une modification du signal de certaines lésions. Techniques structurales Le deuxième concept est microscopique couvrant un large champ incluant l’architecture neuronale, l’agencement et la liberté de mouvement des molécules d’eau, la micro-vascularisation, les marqueurs biochimiques neuronaux et métaboliques, et la fonction cérébrale : IRM fonctionnelle (IRMf). Le transfert d’aimantation permet de distinguer les deux principales composantes de l’eau du cerveau : l’eau libre et l’eau liée aux macromolécules et, en particulier, la myéline. L’imagerie en transfert d’aimantation et le ratio de transfert sont le reflet de l’intégrité cérébrale. Les modifications des ratios de transfert sont visibles avant l’apparition des anomalies morphologiques. La diffusion étudie les mouvements browniens des molécules d’eau. Elle renseigne sur l’architecture tissulaire. La diffusion est isotrope quand elle se fait sans obstacle : c’est le cas de la substance grise. Elle est dite anisotrope quand les molécules d’eau suivent des trajets préférentiels comme pour la substance blanche. Plusieurs paramètres sont générés à partir de cette méthode : le coefficient de diffusion apparent (ADC), mais également la diffusibilité moyenne. La tractographie méthode très prometteuse reconstruit les différents faisceaux. La perfusion explore par l’intermédiaire d’un produit de contraste appelé traceur la microvascularisation cérébrale. Les paramètres générés sont le volume sanguin cérébral (CBV) le flux sanguin cérébral et le temps de transit moyen. La spectroscopie par résonance magnétique ou SRM, cartographie biochimique, analyse de façon parfaitement reproductible le N acétylaspartate (NAA), la choline (Cho), le myo-inositol (Ino) et la créatine (Cr). Les résultats de la SRM sont obtenus sous forme de pics ou sous forme de ratio calculés par rapport à la créatine. Le NAA est un marqueur neuronal, la Cho est le reflet de l’état membranaire, le myo-inositol est le marqueur de la gliose, la créatine le marqueur énergétique. L’IRM fonctionnelle ou IRMf est devenue possible grâce à des séquences rapides et à des paradigmes spécifiques associant des phases d’activation cérébrale et de repos. Elle exploite les changements régionaux cérébraux liés à la concentration de déoxyhémoglobine. Les images morphologiques peuvent nécessiter un post-traitement. Les images structurales ne sont exploitables qu’après un post-traitement. Ce dernier utilise des logiciels spécifiques comme la segmentation, la soustraction et la VBM (Voxel-Based Morphometry), méthode basée sur la comparaison des valeurs des pixels qui est directement corrélée à la densité parenchymateuse. Éléments de neuro-anatomie Le système limbique constitue, chez les mammifères, un lieu de régulation de l'homéostasie intérieure, et d'intégration des fonctions mnésiques, affectives et émotionnelles. Il se compose d'un ensemble de noyaux interconnectés et localisés au sein du mésencéphale (substance grise périaqueducale, aires tegmentales ventrale et dorsale), du diencéphale (habenula, hypothalamus, zona incerta) et du télencéphale (amygdale, septum, aire préoptique et le noyau de la strie terminale). Ces noyaux se trouvent circonscrits par une double ceinture corticale et concentrique. La première, dénommée gyrus intralimbique, inclut successivement: l'hippocampe ventral impliqué dans la mémoire déclarative et la mémoire spatiale, la bandelette de Giacomini, la bandelette diagonale, les stries médiale et latérale (reliquat pericalleux de l'hippocampe dorsal), le gyrus fasciolaris et le gyrus dentatus. La seconde boucle corticale plus périphérique, encore appelée lobe limbique, comprend, quant à elle, les gyrus paraterminal, sous-calleux, cingulaires, rétrosplénial, parahippocampique et périamygdalien. Atrophies et diagnostic des démences Mis à part l’aspect de la substance blanche, les modifications du signal sont subtiles ou absentes en imagerie conventionnelle morphologique. Pendant longtemps la sémiologie neuroradiologique était restée focalisée sur une description subjective de l’atrophie cérébrale. Le substratum neuropathologique visible, secondaire à la dépopulation neuronale corticale et sous-corticale, est caractérisé par l’atrophie cérébrale qui est un élément sémiologique majeur dans le diagnostic des démences. Il n’en demeure pas moins que cette atrophie peut exister de façon physiologique chez le sujet âgé non dément. Pour certains auteurs1, la perte tissulaire cérébrale est de l’ordre de 5,4 cm3 par an pour tout le cerveau, 2,4 cm3 pour la substance grise et 3,1 cm3 pour la substance blanche. Des différences liées au sexe existent. Ainsi les hommes ont plus de substance grise, plus de substance blanche et moins de liquide cérébrospinal (LCS) que les femmes. Un élargissement des espaces sous-arachnoïdiens et une augmentation de la taille des ventricules sont communs au sujet dément et au sujet normal âgé. La démence survenant le plus souvent chez le sujet âgé, il faut distinguer ces deux phénomènes. À côté des méthodes subjectives d’appréciation de cette atrophie, des méthodes plus quantitatives ont été proposées. Cette atrophie n’est pas de répartition uniforme. Les lobes frontal et pariétal sont plus concernés que le lobe temporal ou occipital, le cingulum, l’insula et la face orbitaire du lobe frontal. L’atrophie temporale interne est moins évidente chez le sujet âgé normal. L’atteinte est sectorielle pour la substance grise, diffuse pour la substance blanche. La dilatation ventriculaire progresse de façon moins uniforme. Le rôle de l’imagerie serait de différencier l’atrophie « physiologique » de l’atrophie d’origine démentielle, de trouver des éléments de diagnostic précoce et des éléments prédictifs. Le rôle de l’imagerie serait de différencier l’atrophie « physiologique » de l’atrophie d’origine démentielle, de trouver des éléments de diagnostic précoce et des éléments prédictifs. Il existe une asymétrie hémisphérique avec un hémisphère gauche2 présentant des changements plus rapides et plus prononcés que l’hémisphère droit. Les lobes frontaux et temporaux sont plus souvent intéressés que les aires associatives pariétales. Le lobe occipital ne présente aucune modification notable. En définitive, les questions qui se posent sont les suivantes : - peut-on différencier l’atrophie physiologique de l’atrophie pathologique ? - cette dernière peut-elle prédire le diagnostic de démence au début de l’évolution ? L’attention doit être également prêtée à la corne temporale et à la formation hippocampique. Chez le sujet normal, le volume de l’hippocampe droit est plus grand que le gauche, l’hippocampe féminin serait plus grand que l’hippocampe masculin. Le cortex enthorhinal serait utile dans le diagnostic précoce des démences. Le lobe temporal doit être caractérisé de façon précise. L’atrophie du lobe temporal est-elle polaire, inférolatérale, hippocampique, parahippocampique, est-elle uni- ou bilatérale ? Une échelle simple utilisant la taille des espaces sous-arachnoïdiens et la profondeur des sillons est appliquée pour évaluer l’atrophie3. Une structure anatomique sert également à mesurer les effets de l’âge. Il s’agit de la substance innominée située sous le pallidum4. L’épaisseur de la substance innominée diminue avec l’âge. Son atrophie est le reflet de la dégénérescence du noyau basal de Meynert, responsable d’un déficit cholinergique dans le cortex et souvent rapporté dans la MA. L’épaisseur de la substance blanche est corrélée à la sévérité de l’atteinte clinique dans cette maladie. L’âge modifie de façon constante l’aspect de la substance grise. L’imagerie essaye de discriminer les modifications liées à l’âge et à la pathologie dégénérative par l’intermédiaire des méthodes morphologique, structurale et connective. Ces trois études sont complémentaires, chacune apportant son lot d’informations. L’absence de spécificité des modifications du signal sur les séquences morphologiques ne permet pas de préjuger de l’existence d’un dépôt amyloïde, de plaques séniles. Les premiers facteurs intervenant dans les modifications de la substance blanche sont la démyélinisation et le changement du contenu hydrique, d’où une spécificité peu marquée. L’évaluation de l’atrophie est nécessaire au diagnostic et au suivi des démences. À côté des méthodes subjectives d’appréciation de cette atrophie, des méthodes plus quantitatives ont été proposées. Des techniques d’analyse automatisées (Voxel based morphometry) ou VBM, véritable cartographie de variation régionale de substance grise), les techniques de segmentation anatomique et de modélisation permettent, quant à elles, une approche quantitative et morphométrique. L’ensemble des éléments sémiologiques cités permet de mieux discriminer les différentes formes de démence et d’évoquer le diagnostic de démence au début de la maladie. Ainsi les démences frontotemporales atteignent-elles le cortex entorhinal plus que les hippocampes. L’atrophie hippocampique n’est pas caractéristique de la MA au début, et les démences sémantiques ont une atrophie hippocampique et se caractérisent par une atteinte plus diffuse. Au vu de cette sémiologie, il ressort que les aires les plus récentes sur le plan phylogénétique résistent beaucoup moins bien au processus pathologique et sont plus vulnérables que les aires anciennes. Les principales démences Classiquement et jusqu’à présent, l’imagerie avait souvent pour rôle d’éliminer une hydrocéphalie à pression normale (HPN), un processus occupant de l’espace et évoquer une éventuelle dépression. Une nouvelle ère s’ouvre pour la prise en charge des démences. L’intérêt de l’imagerie aujourd’hui ne se limite plus à éliminer une cause curable de démence ou à retrouver une éventuelle atrophie sur un scanner RX. Elle est partie intégrante d’une prise en charge multidisciplinaire de ces patients. Le diagnostic d’HPN, d’abord clinique, est évoqué sur l’existence de la triade d’Adams, conforté par l’IRM qui retrouve une dilatation ventriculaire intéressant les ventricules latéraux, le 3e ventricule et aussi les cornes temporales. L’aspect des ventricules contraste en principe avec la faible dilatation des espaces sous-arachnoïdiens. L’hypersignal périventriculaire est bien isolé en séquence FLAIR. Il existe des hypersignaux de la substance blanche périventriculaire et de la substance blanche sous-corticale. Le flux est accéléré au niveau de l’aqueduc de Sylvius comme le montre l’absence de signal à ce niveau en séquence de flux du liquide cérébrospinal en contraste de phase ou même sur des séquences sagittales en pondération T2. Les tumeurs susceptibles de se traduire par des troubles neuropsychologiques sont les tumeurs situées dans les régions fronto-orbitaires, le thalamus et sur le système limbique. Le mode de début peut contribuer à un diagnostic tardif. La gliomatose cérébrale peut être à l’origine de troubles du comportement. L’IRM participe au diagnostic et à la prise en charge des démences. Grâce aux nouvelles techniques structurales et connectives et les paramètres qui en découlent, l’IRM doit permettre un dépistage des patients avec un faible déficit cognitif (Mild cognitif impairement ou MCI) et des patients à risque : mutations du gène Preselin-1, (PS1 chromosome 14), du gène Preselin-2 (PS2 chromosome 1) et du gène APP (amyloïd precursor protein) sur le chromosome 21. Elle doit permettre aujourd’hui d’établir un suivi thérapeutique et fait partie intégrante des essais cliniques. La maladie d’Alzheimer Décrite en 1907, c’est une cause fréquente de démence. La localisation des processus pathologiques est à la fois intraneuronale (neurofibrilles) et extraneuronale (plaques séniles), avec une destruction progressive des neurones corticaux. Les lésions neurofibrillaires caractéristiques de la maladie débutent dans la couche 2 de l’aire 35 de Brodmann. La maladie d’Alzheimer se caractérise toujours par une atteinte symétrique amygdalo-hippocampique d’une part, et une intégrité des aires primaires sensori-motrices et visuelles, d’autre part. L’atrophie est diffuse à la fois corticale et sous-corticale avec élargissement des espaces sous-arachnoïdiens et du système ventriculaire (Figures 4 et 5). Figure 4. Maladie d’Alzheimer, IRM. Coupes céphaliques sagittales en PT1(a), en FLAIR (b) axiales en PT2 (b), et en diffusion (d). Atrophie majeure des deux lobes temporaux, avec dilatation des deux cornes temporales et élargissement des espaces sous-arachnoïdiens. Légères modifications du signal des lobes temporaux en FLAIR. L’atteinte prédomine à droite. Mesure des coefficients de diffusion apparents en (d). Figure 5. Maladie d’Alzheimer (forme débutante), IRM. Coupes céphaliques axiales (a, b), et coronale (c) en PT2, en FLAIR (d). Atrophie des gyri temporaux et de la convexité pariétale postérieure. L’atteinte hippocampique n’est pas encore visible. Le diagnostic différentiel doit se faire avec une atrophie liée à l’âge. Dans la MA, l’atteinte de la formation hippocampique n’est pas caractéristique. Elle donne néanmoins un élargissement net des cornes temporales, des citernes circum-pédonculaire et suprasellaire. Si l’atteinte hippocampique n’est pas caractéristique, l’atteinte du cortex enthorinal au début est très suggestive. Des méthodes de quantification semi-automatiques ou mieux encore automatiques permettent d’évaluer le volume hippocampique. Il existe des différences significatives de la qualité de la perte neuronale entre les formes de début et les formes tardives de MA. Au début de la maladie, les régions pariéto-temporales et le cingulum postérieur sont atteints comme le montrent les études en VBM5. Plus tard, s’ajoute une atteinte de la face mésiale du lobe temporal. La substance blanche présente des anomalies de signal de topographie sous-corticale ou périventriculaire de façon fréquente. Les anomalies de signal de la substance blanche peuvent faire partie du substratum pathologique de la MA ou faire partie d’une MA avec une composante vasculaire. La coexistence des deux entités rend le diagnostic difficile. Le profil SRM montre une diminution du rapport NAA/créatine et une augmentation du rapport myo/créatine en temporal et en pariétal. Le rapport Cho/créatine est également augmenté selon les profils cliniques (Figure 6). Figure 6. Maladie d’Alzheimer, IRM et profil spectroscopique en SRM. Coupe céphalique coronale en PT2 (a). SRM = diminution du N-acétyl-Aspartate, augmentation modérée du myoinositol. Les données de la perfusion seraient superposables aux données de la consommation de glucose en PET-scan. Ainsi, il a été mis en évidence une réduction du CBV en temporo-pariétal, dans le cortex sensitivomoteur6 et au niveau de l’hippocampe avec une grande sensibilité et une grande spécificité. L’atrophie, les plaques séniles peuvent expliquer cette baisse du CBV. Les données du tenseur de diffusion se traduisent par une réduction de l’anisotropie de la substance blanche. La diffusion des molécules d’eau est facilitée suite aux phénomènes pathologiques, source d’une modification du cytosquelette des connexions cellulaires et fasciculaires. La gliose cicatricielle désorganise également l’architecture initiale. L’atteinte de la substance blanche est-elle liée ou non à la MA ? Les études en tenseur de diffusion7 montrent que ces lésions se localisent à la substance blanche connectée au cortex associatif et épargnent la capsule interne et les radiations optiques. Ainsi le splénium du corps calleux, le faisceau longitudinal supérieur et le cingulum voient leur anisotropie diminuée. La dégénérescence wallérienne des fibres de la substance blanche secondaire à la perte neuronale du cortex associatif est le principal mécanisme à l’origine de ces modifications pathologiques. Les troubles cognitifs légers ou mild cognitif impairement sont de plus en plus désignés comme étant le précurseur de la maladie d’Alzheimer, avec atteinte isolée de la mémoire secondaire. Le taux de conversion annuel d’un MCI en MA est de 15 %. Cette phase « initiale » doit bénéficier de plus en plus d’une exploration IRM multimodalités, à la recherche d’anomalies structurales et connectives infracliniques (Figures 7 et 8) comme l’ont montré des études en transfert d’aimantation, en SRM et en IRMf dans d’autres pathologies du système nerveux central. Figure 7. Déficit cognitif léger et antécédent familial de maladie d’Alzheimer, IRM. Coupes céphaliques axiales (a, b) et coronales en PT2 (c), et en FLAIR (d). Atrophie localisée du lobe temporal droit avec zones d’hypersignal en pondération FLAIR. Figure 8. Déficit cognitif d’apparition récente chez un patient jeune avec antécédents de méningite et épilepsie, IRM. Coupes céphaliques coronales en PT2 (a,b,c). La seule dilatation de la corne temporale droite ne permet pas de préjuger de la nature et de l’ancienneté de cette modification. Le taux de conversion annuel d’un MCI en MA est de 15 %. Des zones d’hyperactivité ou d’hypoactivité plus ou moins étendues, sont retrouvées en IRMf. La démence à corps de Lewy Les inclusions neuronales furent décrites en 1912 par Friedrich Lewy. Cette entité réprésente environ 15 à 30 % des démences. C’est une démence associée à une maladie de Parkinson. Son hypersensibilité aux neuroleptiques et les hallucinations visuelles la caractérisent. Les corps de Lewy, qui ne sont pas spécifiques de la maladie de Parkinson, sont localisés dans le cortex, les noyaux sous-corticaux mais surtout dans l’hippocampe. L’absence des neurofibrilles est la différence essentielle avec la maladie d’Alzheimer8. L’atrophie est à prédominance frontale, l’atteinte temporale est moins prononcée ou peut même manquer. En SRM, le rapport Cho/créatine est également augmenté. L’augmentation du rapport Cho/Cr caractérise les démences avec un déficit cholinergique, comme la maladie d’Alzheimer, la démence à corps de Lewy, la démence frontotemporale (Figure 9). Figure 9. Démence frontotemporale, IRM. Coupes, axiales en PT2 (a,b,c) et en diffusion (d). Atrophie des secteurs temporopolaires, frontaux et, à moindre degré, pariétal. Modifications en secteur des coefficients apparents de diffusion. La démence de Pick Décrite en 1892 par Arnold Pick, elle représente environ 10 % des démences. En fait, cette forme de démence est constituée de trois entités, avec les corps de Pick intraneuronaux représentant des protéines Tau pathologiques, une simple dégénérescence frontotemporale avec gliose et spongiose et une forme associée à une atteinte du motoneurone. Un profil héréditaire est retrouvé dans 30 % des cas, avec une localisation sur le chromosome 17 (17q21-22). L’atrophie massive prédomine en topographie frontale et temporale, souvent de façon asymétrique (Figure 10). Figure 10. Démence de Pick, IRM. Coupes céphaliques sagittales en PT1 (a,b), axiales en FLAIR (c, d). Atteinte frontotemporale avec sillons taillés au couteau. Les cornes temporales sont dilatées. Quelques hypersignaux sont notés en FLAIR. Les circonvolutions sont amincies (Knife-edge convolutions), les ventricules sont très larges, les cornes frontales sont ballonisées. La circonvolution temporale supérieure est en principe épargnée, de même que la circonvolution de Heshl9 et le planum temporal. L’atrophie intéresse les noyaux gris centraux et, en particulier, la tête du noyau caudé avec disparition de l’empreinte de ce dernier sur les cornes frontales. L’atrophie des pédoncules cérébraux est la conséquence directe de la dégénérescence des fibres frontopontiques. Les anomalies de signal du cortex et de la substance blanche (gliose) ne sont pas caractéristiques mais progressent avec l’évolution de la maladie. L’imagerie en perfusion montre une diminution de cette dernière en frontal et en temporal. Le profil SRM montre une diminution du rapport NAA/ créatine en frontal, et une augmentation du rapport myo-inositol/créatine. Le rapport Cho/ créatine est également augmenté. Aphasie progressive et démence sémantique Les aphasies primaires apparaissent (Mesulam 1982) vers la sixième décade et se distinguent en aphasies fluentes et non fluentes. La mémoire est préservée et l’aphasie peut être le seul symptôme pendant de longues années, environ une dizaine d’années avant l’apparition d’une démence globale (Figure 11). L’aphasie sémantique se traduit par une perte du sens et de la signification des mots. La fluence est normale. L’atrophie cortico-sous-corticale est asymétrique avec une prédominance gauche avec élargissement des espaces sous-arachnoïdiens en périsylvien, mais aussi du ventricule latéral et de la corne temporale. L’atrophie du lobe temporal gauche concerne tous les gyri et est soulignée par des anomalies de signal de la substance blanche (Figure 11). Figure 11. Aphasie progressive, IRM. Coupes céphaliques axiales en PT2 (a,b,c) et en inversion de contraste (d). Atteinte quasi exclusive du lobe temporal gauche avec dilatation de la corne temporale. Des entités avec latéralisation temporale droite de l’atrophie Tyrrel (1990) et Edwards-Lee (1997) ont été décrites10. La démence vasculaire Il s’agit de la deuxième cause de démence (Figure 12). Figure 12. Démence vasculaire, IRM. Coupes céphaliques axiales (a) et coronales (b) en PT2, et axiales (c, d) en FLAIR. Atrophie corticale, leuco-encéphalopathie diffuse, images lacunaires et dilatations des espaces périsylviens. Une différence existe entre les démences vasculaires et les démences après accident vasculaire cérébral. La démence vasculaire représente environ 15 % des démences. Les patients atteints de MA ne sont pas indemnes de lésions vasculaires. Sans anomalies de signal en IRM, il est très improbable d’évoquer le diagnostic de démence vasculaire. Leur présence n’élimine pas une autre cause de démence, en particulier, une MA. Enfin les deux entités peuvent coexister. Comme pour l’atrophie, les anomalies de la substance blanche sont fréquentes à partir d’un certain âge. Sans anomalies de signal en IRM, il est très impro- bable d’évoquer le diagnostic de démence vasculaire. Les séquences T2 et FLAIR retrouvent des anomalies confluentes de la substance blanche, des hypersignaux périventriculaires, des lésions lacunaires au niveau des noyaux gris centraux pouvant aller jusqu’aux états criblés et lacunaires et des microhémorragies bien visibles en pondération T2*. Les infarctus peuvent être silencieux, situés ou non dans des secteurs stratégiques. Au niveau de la fosse postérieure, les anomalies de signal au niveau des fibres transversales du pont sont très suggestives et peuvent s’associer à des lésions ischémiques du cervelet. Ces anomalies ne sont pas spécifiques. Elles sont la traduction de plusieurs substratum pathologiques à la fois gliose, démyélinisation, etc. L’angiopathie amyloïde, le CADASIL (cerebral autosomal dominant arteriopathy with subcortical infarctions and leukoencephalopathy), les vascularites, l’athérosclérose et la maladie de Binswanger ou (subcortical arteriosclerotic encephalopathy) sont à l’origine de ces atteintes de la substance blanche. Le profil SRM montre une diminution du rapport NAA/créatine, traduction d’une perte neuronale. Les lactates sont élevés à la phase aiguë. Le complément d’exploration peut faire appel au Doppler et à l’ARM des vaisseaux à destinée cervico-céphalique avec injection de gadolinium. Les facteurs de risque vasculaire, les déficits focaux et le mode évolutif permettent, entre autres, d’évoquer cette étiologie. Les syndromes parkinsoniens et démences La dégénérescence cortico-basale Elle fut décrite pour la première fois par Rebeiz en 1967. La présentation clinique est asymétrique. Des inclusions neuronales (tau-immunoréactives) au niveau de la couche II du cortex, associées à une microvacuolisation du cortex frontotemporal sont les signatures neuropathologiques, avec une perte neuronale, une gliose associée et une dégénérescence neurofibrillaire des noyaux sous-corticaux. Un patient sur deux développe une démence. La réponse à la L-Dopa est négative. À l’asymétrie de l’atteinte clinique correspond une asymétrie anatomique. En effet l’IRM montre essentiellement une atrophie asymétrique corticale frontale postérieure et pariétale, avec une région centrale et postcentrale amincie. Le cortex aminci est en hypersignal en séquence FLAIR. Le volume de la substance blanche est réduit. Les noyaux gris centraux peuvent présenter un certain degré d’atrophie avec un aspect hypointense des putamens. La SRM est peu contributive (Figure 13). Figure 13. Dégénérescence cortico-basale, IRM. Coupes céphaliques axiales (a, b) et coronales en PT2 (c). Atteinte caractéristique et latéralisée à droite, localisée au lobe temporal et à la région centrale. La paralysie supranucléaire progressive (syndrome de Steele-Richardson-Olszewski) La réponse à la L-Dopa est mauvaise. La plupart des patients présentent une détérioration cognitive. L’affection est responsable d’une dégénérescence touchant les noyaux oculomoteurs, le striatum, la substancia nigra et le néocortex. La perte neuronale, avec gliose et une vacuolisation dégénérative sont retrouvées autour de la substance grise périaqueducale. Il existe à la fois une atteinte du système pyramidal et extrapyramidal. En IRM, l’atrophie est localisée au mésencéphale avec dilation des citernes ambiantes, prépontiques et circum-mésencéphaliques. Les anomalies de signal sont rares. La lame tectale est fine, l’aqueduc de Sylvius large. L’image la plus caractéristique est l’aspect en oeil de tigre constitué par un hyposignal très marqué des pallidum associé à deux hypersignaux en T2 dus à la gliose et à la vacuolisation (Figure 14). Figure 14 : Paralysie supranucléaire progressive, IRM. Coupes céphaliques, sagittale en PT1 (a) et coronale oblique en Ca-Cm (b). Aspect atrophique de la lame tectale et des corps mamillaires, atrophie temporale. Les atrophies multisystématisées (syndrome de Shy-Drager, atrophie olivo-ponto-cérebelleuse, dégénérescence striato-nigrique) Elles se distinguent par un syndrome parkinsonien, un syndrome cérébelleux et des signes pyramidaux. Des inclusions gliales cytoplasmiques et nucléaires sont retrouvées en histologie. Les signes IRM sont peu spécifiques. L’atrophie corticale, des noyaux gris centraux du tronc cérébral ou du cervelet est présente à des degrés variables. Le complexe sclérose latérale amyotrophique-parkinsonisme et démence peut être évoqué sur les hypersignaux en T2 sur le faisceau cortico-spinal. Autres démences La démence alcoolique ou syndrome de Wernicke-Korsakoff constitue la principale entité. L’atrophie corticale et cérébelleuse sont bien connues. Les lésions du syndrome de Wernicke se localisent aux corps mamillaires, le thalamus en regard du 3e ventricule, la substance grise périaqueducale, la substance réticulée du tronc et la lame tectale. Dans le syndrome de Marchiafava-Bignami, la localisation au corps calleux est quasi pathognomonique avec un aspect kystique au stade séquellaire. L’atrophie des corps mamillaires et du thalamus est bien visualisée sur les coupes axiales et coronales dans les formes chroniques de maladie de Wernicke. La myélinolyse centro- et extrapontique secondaire à la correction rapide des troubles osmotiques entraîne un hypersignal en T2 et un hyposignal en T1, protubérantiel central épargnant la périphérie de cette structure, mais il existe une forme de myélinolyse extrapontique plus diffuse avec une atteinte des noyaux gris des capsules interne et externe. Les encéphalites limbiques sont secondaires à une réaction auto-immune avec des anticorps dirigés contre le système nerveux central. Elles accompagnent un tableau paranéoplasique. L’IRM permet d’évoquer le diagnostic sur des anomalies très caractéristiques. Les anomalies en hypersignal en T2 sont situées au niveau de la partie mésiale du lobe temporal et des amygdales, du gyrus cingulaire, et de l’hypothalamus. La barrière hémato-encéphalique peut être rompue, il n’existe aucune corrélation radioclinique. L’imagerie s’appliquera à rechercher un cancer pulmonaire à petites cellules, un thymome, un cancer de la prostate entre autres. Conclusion • La prise en charge des patients atteints de démence est une prise en charge délicate, mettant en jeu des facteurs sociaux, familiaux et médicaux. • Une nouvelle ère, moins contemplative, de l’atrophie et du diagnostic différentiel avec des affections réputées curables doit commencer. • Faisant partie intégrante des protocoles de recherche en neurosciences, l’imagerie morphologique structurale, d’abord, mais aussi de en plus connective et fonctionnelle, sert à appréhender certains mécanismes pathologiques. Elle contribue à dépister les patients à risque, et accompagne les essais thérapeutiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :