Publié le 02 nov 2021Lecture 20 min
Les accidents vasculaires cérébraux de l’enfant
Yannick BÉJOT et coll.*, Service de neurologie, CHU de Dijon
L’accident vasculaire cérébral (AVC) de l’enfant est très différent de celui de l’adulte car l’âge et la plasticité cérébrale font que la séméiologie, les causes et l’évolution sont très différentes. Il faut donc oublier ce que l’on sait de l’adulte, en particulier sur le plan étiologique. En revanche, la prise en charge bénéficie du même raisonnement et, a priori, des mêmes traitements curatifs et préventifs, bien qu’aucun essai thérapeutique n’ait été réalisé dans ce groupe de population.
Dans le cadre de la veille sanitaire sur les accidents vasculaires cérébraux (AVC) mise en place à Dijon depuis 1985(1), nous avons été amenés à aborder l’AVC du nouveau-né et de l’enfant, et à incorporer les données pédiatriques dans notre registre de population. Le regard du neurologue d’adultes vient ainsi éclairer la vision des AVC survenant dans l’enfance. Ces derniers se démarquent des AVC de l’adulte par une présentation clinique, des facteurs de risque, des causes et un pronostic vital et fonctionnel différents(2). Les recommandations pour la prise en charge en phase aiguë sont également spécifiques à cet âge(3).
Comme chez l’adulte, l’AVC met en jeu l’avenir moteur et cognitif de l’enfant, mais contrairement à l’adulte, l’étonnante plasticité du cerveau de l’enfant explique des récupérations parfois inattendues contrastant avec l’étendue des lésions.
Peu d’études se sont réellement intéressées à l’épidémiologie des AVC chez les moins de 18 ans. Dans cet article, nous envisageons les données cliniques, épidémiologiques, la physiopathologie, les spécificités et les conséquences du retard diagnostique de l’AVC chez l’enfant. Les recommandations en vigueur pour leur prise en charge à la phase aiguë seront rappelées, à travers une revue de la littérature et quelques résultats locaux(1).
Épidémiologie de l’AVC de l’enfant
Cet article concerne les AVC survenant chez les enfants (et les adolescents), âgés entre 1 et 18 ans(4,5). Comme pour les AVC néonataux, l’incidence des AVC chez l’enfant a été peu étudiée. L’incidence varie entre 1,3 et 13/100 000 enfants/an, mais les différences méthodologiques comme les modalités de recueil des cas ou encore l’âge retenu des enfants rendent difficiles les comparaisons.
Ainsi, seule l’étude dijonnaise, qui mettait en évidence les taux d’incidence les plus élevés(4), répondait aux critères de qualité pour la mesure de l’incidence des AVC. Les autres études étaient rétrospectives, pour la plupart établies à partir de cohortes hospitalières(6). Seuls 50 % des enfants avaient bénéficié d’un scanner cérébral.
Ces éléments peuvent expliquer une possible sous-estimation de l’incidence réelle des AVC chez l’enfant. Des facteurs génétiques, ethniques et socio-économiques peuvent également être à l’origine de différences d’incidence observées entre les études. En effet, dans l’étude conduite en Californie à partir de données hospitalières, il a été établi que l’incidence variait en fonction de l’origine ethnique des enfants(7).
Ainsi, elle était de 1,99/100 000/an pour les enfants d’origine caucasienne, très proche de celle observée pour les enfants d’origine asiatique (1,9/100 000/an) et de celle des enfants d’origine hispanique (1,5/100 000/an), mais bien inférieure à celle des enfants afroaméricains (4,22/100 000/an).
Concernant la comparaison entre l’incidence des infarctus cérébraux et celle des hémorragies cérébrales, les résultats des études divergent. Certaines retrouvent une incidence plus élevée pour les infarctus(4,7), alors que d’autres mettent en évidence l’inverse(8). Cependant, nous pouvons retenir que les incidences sont proches, à l’opposé de ce qui est observé chez l’adulte où les infarctus cérébraux sont dix fois plus fréquents que les hémorragies cérébrales(1,9). Ainsi, l’incidence des AVC chez l’enfant est bien inférieure à celle observée en période néonatale.
Physiopathologie
Ischémie cérébrale
Comme chez l’adulte, l’ischémie cérébrale résulte d’une chute du débit sanguin cérébral (DSC), le plus souvent en rapport avec l’occlusion d’une artère cérébrale par du matériel embolique. Les conséquences tissulaires de cette hypoperfusion dépendent de sa durée et de son intensité(10).
La zone d’ischémie cérébrale peut schématiquement se diviser en trois parties, en allant de la périphérie vers le centre :
- une zone d’olighémie modérée où la réduction de la perfusion cérébrale n’a aucune traduction clinique ;
- une zone appelée pénombre où le DSC est encore suffisant pour assurer un apport énergétique permettant la survie des cellules, mais insuffisant pour permettre leur fonctionnement. Cette zone est responsable d’un déficit neurologique. En cas de restauration précoce d’un DSC normal, la zone de pénombre peut évoluer vers un retour à la normale avec, parallèlement, disparition du déficit neurologique. En revanche, si le DSC reste identique, la zone de pénombre évolue vers la nécrose en quelques heures et le déficit neurologique est constitué. Le phénomène de pénombre dépend, en effet, de deux facteurs : l’intensité de la baisse du DSC et sa durée ;
- une zone de nécrose traduisant une défaillance des systèmes de défense cellulaire à l’hypoxie avec mort cellulaire, responsable d’un déficit neurologique constitué et persistant même en cas de restauration précoce d’un DSC normal.
La pénombre étant évolutive dans le temps, la démarche thérapeutique consiste soit à rétablir un DSC normal dans le zone de pénombre (maintien de la pression artérielle, thrombolyse), soit à permettre à cette zone de pénombre de tolérer le plus longtemps possible cette situation en attendant une recanalisation spontanée par thrombolyse ou mise en jeu de suppléances (neuro-protection). L’ischémie est responsable d’une glycolyse anaérobie, d’une acidose intracellulaire et, par perturbations des canaux calciques récepteur- et voltage-dépendants, d’une inflation calcique intracellulaire. Le calcium, deuxième messager intracellulaire, favorise une activation enzymatique qui est responsable de la destruction cellulaire.
L’ischémie cérébrale a deux caractéristiques qui la différencient de l’ischémie myocardique :
- d’une part, la pathologie est hétérogène, chaque sous-type d’ischémie cérébrale ayant un pronostic différent et exposant à des risques différents : occlusion des petites artères intracérébrales, cardiopathies emboligènes, autres causes établies (dissections des vaisseaux cervicaux, causes hématologiques, angéites, etc.) et les causes indéterminées (deux causes plausibles d’infarctus cérébral ou plus, bilan complet mais négatif, ou bilan incomplet) ;
- d’autre part, la particularité de l’infarctus cérébral est aussi sa fréquente transformation hémorragique.
Hémorragie cérébrale
Dans l’hémorragie cérébrale spontanée, la cause peut être une malformation vasculaire (anévrisme, angiome, cavernome), une lipohyalinose des artères perforantes en rapport avec une hypertension artérielle chronique, une angiopathie amyloïde, une thrombose veineuse ou des troubles de l’hémostase.
L’hémorragie est responsable de lésions cérébrales par différents mécanismes :
- une destruction du parenchyme ;
- un refoulement du parenchyme par l’hémorragie ;
- un engagement ;
- et une ischémie cérébrale secondaire à la baisse de la pression de perfusion cérébrale.
En aucun cas, une pression artérielle élevée ne peut être la cause directe de l’hémorragie : l’hypertension artérielle chronique est responsable d’une lipohyalinose des perforantes qui fragilise ces artères de petit calibre, et entraîne des hémorragies, généralement profondes.
Spécificités cliniques
La symptomatologie clinique est variable en fonction de l’âge de l’enfant. Ainsi, avant 10 ans, le mode de révélation est brutal et se fait, le plus souvent, sous forme d’une hémiplégie fréquemment associée à une hyperthermie et des convulsions épileptiques, souvent généralisées(5). Après 10 ans, la symptomatologie clinique est proche de celle observée chez l’adulte.
Causes des AVC de l’enfant
Leur recherche repose sur un interrogatoire précis des parents (tableau).
Infarctus cérébraux
- Causes cardiaques
Comme chez le nouveau-né, les pathologies cardiaques sont une cause très fréquente d’infarctus cérébral de l’enfant, représentant environ 25 % de l’ensemble des causes retrouvées à cet âge(11). Dans la plupart des cas, une embolie est responsable de l’atteinte cérébrale. De nombreuses pathologies cardiaques ont été identifiées, dont les cardiopathies congénitales. Certaines sont spécifiques à l’enfant comme la tétralogie de Fallot, la transposition des gros vaisseaux, une sténose pulmonaire ou encore la coarctation de l’aorte. De même, les valvulopathies (congénitales, prolapsus mitral, rétrécissement mitral rhumatismal, endocardite infectieuse, endocardite de Libman-Sacks, endocardite thrombotique non bactérienne, calcifications valvulaires, tumeurs valvulaires, prothèses valvulaires), les arythmies cardiaques (fibrillation auriculaire, tachycardie supraventriculaire, maladie du sinus), ou encore les cardiomyopathies (infarctus du myocarde, anévrisme du ventricule gauche, myocardite, tumeurs cardiaques, ataxie de Friedreich, syndrome de Kearns-Sayre) peuvent être responsables d’infarctus cardio-emboliques chez l’enfant comme chez l’adulte(12). Il est recommandé de réaliser un traitement chirurgical des cardiopathies congénitales à risque lorsque celui-ci est envisageable (mis à part le foramen ovale perméable) et de procéder à l’exérèse d’un myxome de l’oreillette(3).
- Angiopathies
• Les dissections des artères cervicales représentent 6 à 20 % des causes d’infarctus cérébral chez l’enfant(11). Cette pathologie affecte davantage les garçons que les filles, et il a été rapporté que les dissections spontanées touchaient plus fréquemment le segment intracrânien des artères, à l’inverse des dissections post-traumatiques plus souvent localisées sur la portion extracrânienne(7).
Certaines affections prédisposent à la survenue d’une dissection artérielle cervicale comme la dysplasie fibromusculaire, le syndrome de Marfan, le syndrome d’Ehlers-Danlos de type IV, la coarctation de l’aorte, la polykystose rénale, l’ostéogenèse imparfaite, le syndrome de Moya-Moya ou encore le pseudoxanthome élastique. Par ailleurs, certains auteurs ont noté un épisode infectieux précédant la survenue de la dissection, suggérant une fragilisation des parois vasculaires par un processus inflammatoire(5). Enfin, le risque de récurrence est élevé, de l’ordre de 1 % par an, et semble augmenté en cas d’antécédent familial de dissection artérielle ou de pathologie prédisposante sous-jacente comme la dysplasie des artères cervicales et rénales.
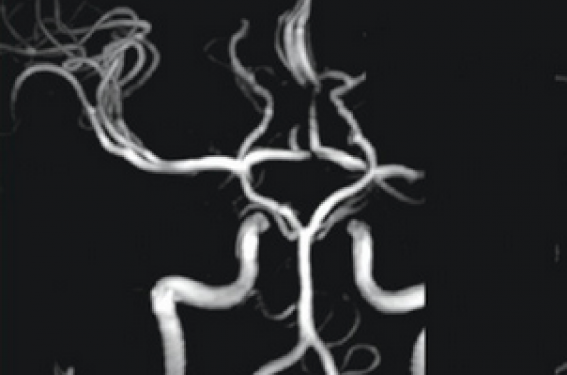
Bien que son incidence dans la population générale soit faible, estimée aux États-Unis à 0,06/ 100 000/an chez les sujets caucasiens et 0,28/100 000/an chez les sujets d’origine asiatique(13), la maladie de Moya-Moya représente une cause remarquable d’infarctus cérébral chez l’enfant, ce dernier étant le plus souvent précédé par des accidents ischémiques transitoires, volontiers récidivants, alternants et favorisés par l’hyperpnée. Cette pathologie est caractérisée par une sténose progressive bilatérale de la terminaison de la carotide interne associée au développement d’un réseau collatéral de suppléance, conférant en angiographie un aspect en nuage de fumée(14).
Deux cas (6 %) ont été identifiés, dont un survenant chez une fille d’origine coréenne(5,14). Des syndromes de Moya-Moya peuvent aussi être observés dans le cadre de certaines pathologies comme la drépanocytose, une méningite purulente, les neurofibromatoses de type 1, la trisomie 21, un syndrome de Williams ou encore dans les suites d’une radiothérapie(2,13).
• Les angéites cérébrales peuvent également être responsables d’infarctus cérébral chez l’enfant. Elles peuvent compliquer une infection bactérienne ou virale. La plus commune à cet âge est l’angéite post-varicelleuse, qui se caractérise par une atteinte artérielle nécrosante(15), mais de nombreux autres micro-organismes peuvent être impliqués comme le bacille tuberculeux, le pneumocoque, le méningocoque, les spirochettes, les rickettsies, le VIH, ou encore les infections fongiques.
• Le syndrome urémique et hémolytique (SHU) peut être responsable d’infarctus cérébraux relevant d’un processus thrombogène(2).
• Le syndrome de Susac ou Small infarctions of cochlear, retinal and encephalic tissue (SICRET) est une vascularite de cause inconnue touchant les petits vaisseaux et générant des infarctus de petite taille. La symptomatologie clinique associe une surdité unilatérale, des occlusions des vaisseaux rétiniens et une encéphalopathie(1).
• Des angéites auto-immunes, notamment en cas de lupus érythémateux disséminé, ont été également décrites. Enfin, la maladie de Takayasu est une artérite apparaissant à l’adolescence et touchant volontiers la jeune fille. Elle doit être suspectée en cas d’asymétrie tensionnelle ou d’abolition des pouls aux membres supérieurs.
• Le rôle exact de la migraine comme cause d’infarctus cérébral chez l’enfant reste encore mal déterminé. Par ailleurs, des déficits neurologiques persistants ont été observés dans les suites de crises de migraine hémiplégique familiale(1).
- Causes hématologiques
Contrairement à l’adulte, les maladies hématologiques sont une source importante d’infarctus cérébral chez l’enfant. La drépanocytose est classique dans la population noire africaine et cette maladie multiplie le risque d’infarctus cérébral par 200 à 400(1). Ainsi, 10 % des porteurs de drépanocytose présentent un infarctus cérébral symptomatique avant l’âge de 20 ans, alors que 20 % présentent des lésions ischémiques silencieuses, et le risque de récidive est extrêmement élevé, de l’ordre de 50 % à 3 ans. L’atteinte implique plus souvent les grosses artères (59 %) que les petits vaisseaux cérébraux (32 %). D’un point de vue physiopathologique, les crises drépanocytaires augmenteraient la viscosité sanguine du fait de la présence de l’hémoglobine HbS anormale, ce qui induirait des occlusions artérielles. Une hydratation, une correction de l’hypoxémie et de l’hypotension sont également à réaliser(3).
D’autres maladies des globules rouges comme les thalassémies ou l’hémoglobinurie paroxystique nocturne ont été également identifiées comme causes d’infarctus chez l’enfant(2).
Les troubles de la coagulation exposent à un risque accru de thrombose, notamment les déficits en protéine C, protéine S, antithrombine, les mutations du facteur V de Leiden et de la prothrombine, et le syndrome des antiphospholipides. Ces anomalies représenteraient jusqu’à 38 % des causes d’infarctus cérébral chez l’enfant(11).
Enfin, les syndromes lymphoet myéloprolifératifs, au premier rang desquels figurent les leucémies aiguës, sont à l’origine à la fois d’infarctus cérébraux, favorisés par l’augmentation de la viscosité sanguine, une coagulation intravasculaire disséminée ou la radiothérapie, mais aussi d’hémorragies cérébrales par thrombopénie ou hypofibrinogénémie(2). Ces causes sont plus fréquentes après l’âge de 10 ans et doivent être évoquées en priorité afin de bénéficier d’un traitement spécifique.
- Causes métaboliques et génétiques
• L’homocystinurie est une cause rare de thrombose artérielle pouvant entraîner un infarctus cérébral chez l’enfant(1). Les manifestations cliniques de cette maladie associent en outre un aspect marfanoïde, une ectopie du cristallin, un retard mental et des crises épileptiques. L’anomalie génétique porte sur une des enzymes contrôlant le métabolisme de la vitamine B12 : la cystathionine bêta-synthase ou, plus rarement, l’homocystéine méthyltransférase (MTHFR). Le traitement repose sur un régime pauvre en méthionine, l’administration de pyridoxine, vitamine B12, acide folique et bétaïne.
• La maladie de Fabry est une maladie héréditaire lysosomale de transmission génétique liée au chromosome X, caractérisée par un déficit en alpha-galactosidase A responsable de l’accumulation de glycosphingolipides non dégradés dans le plasma et les lysosomes de nombreux types cellulaires(1). L’affection touche les garçons et se manifeste cliniquement dès l’enfance par des crises douloureuses des extrémités, des signes cutanés (angiokératomes), des troubles digestifs, une hypohydrose et des dépôts cornéens. Les complications rénales, cardiaques et neurologiques apparaissent généralement plus tardivement. Néanmoins, des cas d’infarctus cérébral touchant préférentiellement le territoire vertébrobasilaire, ont été notés chez le grand enfant. L’enzymothérapie substitutive permet de prévenir l’évolution de la maladie.
• Les mitochondriopathies peuvent également être responsables d’infarctus cérébral chez l’enfant. La plus fréquente est le syndrome MELAS qui associe une intolérance à l’effort, des crises comitiales, une acidose lactique, des manifestations neurologiques pseudovasculaires et la présence de fibres rouges déchiquetées à la biopsie musculaire. Des lésions ischémiques cérébrales peuvent être retrouvées, impliquant particulièrement la région postérieure des hémisphères cérébraux.
• D’autres causes peuvent être mentionnées. Le syndrome CADASIL de transmission autosomique dominante, résultant de la mutation du gène NOTCH3 sur le chromosome 19, a été décrit dans de rares cas chez l’enfant(1).
• Les phacomatoses peuvent également se compliquer d’infarctus cérébral chez l’enfant. Ainsi, la maladie de Von Recklinghausen peut induire un syndrome de Moya-Moya ou une hypertension artérielle sévère par neurofibromatose des artères rénales ou phéochromocytome(1). La sclérose tubéreuse de Bourneville peut se compliquer de rhabdomyomes intracardiaques générant des infarctus cérébraux cardio-emboliques(1,2).
• Les dyslipoprotéinémies héréditaires telles que l’hypoalphalipoprotéinémie familiale, l’hypercholestérolémie familiale, les hyperlipoprotéinémies de type III et IV, la maladie de Tangier et la progéria de Hutchinson-Gilford peuvent également être responsables d’infarctus cérébraux(12).
• Enfin, le syndrome de Carney de transmission autosomique dominante se caractérise par une pigmentation tachetée de la peau (lentigines et nævus bleus), une hyperactivité endocrinienne et des myxomes cardiaques pouvant également induire des embolies cérébrales(1).
Hémorragies cérébrales
Les principales causes d’hémorragies cérébrales sont les malformations artérioveineuses (MAV). Elles représentent entre 14 et 57 % de l’ensemble des causes d’hémorragies selon les séries(1), et le risque annuel d’hémorragie cérébrale chez les enfants porteurs d’une MAV est d’environ 3 %(1), plus faible que celui observé chez l’adulte. Néanmoins, le risque cumulé est plus important du fait de l’espérance de vie plus grande à cet âge. Enfin, le risque de récidive est très élevé, de l’ordre de 25 % à 5 ans. Le traitement spécifique ne diffère pas de celui de l’adulte et repose sur la chirurgie, le traitement endovasculaire ou la radiothérapie stéréotaxique(2).
• Les anévrismes artériels intracrâniens peuvent également se compliquer d’hémorragie parenchymateuse et ont été impliqués dans 5 à 29 % des cas. Ils peuvent être isolés ou associés à une coarctation de l’aorte, une polykystose rénale(5) ou encore un syndrome d’Ehlers-Danlos de type IV, un pseudoxanthome élastique ou une dysplasie fibromusculaire. De rares cas d’anévrismes infectieux peuvent également être rencontrés. L’âge de survenue de l’hémorragie cérébrale est biphasique, avec une incidence plus forte avant 2 ans et après 10 ans. Un traitement chirurgical ou endovasculaire est indiqué comme chez l’adulte(2).
• Les cavernomes ont longtemps été méconnus avant l’arrivée de l’IRM dans les outils diagnostiques. Ils pourraient cependant représenter jusqu’à 25 % des cas d’hémorragies cérébrales(4). Ils sont uniques ou multiples, pouvant, dans ce dernier cas, révéler une cavernomatose familiale par mutation du gène CCM1, CCM2 ou CCM3(16). Leur traitement fait appel à la chirurgie ou la radiochirurgie stéréotaxique(2).
• Les tumeurs cérébrales sont également à l’origine d’hémorragies (3 à 22 % des cas), mais certaines études excluaient ces causes(1).
• D’autres facteurs étiologiques ont été identifiés comme les troubles hématologiques impliqués dans 10 à 30 % des cas, incluant les hémopathies malignes, les coagulopathies, les thrombocytopénies ou encore les hémophilies(1,5).
Enfin, malgré les progrès réalisés dans les techniques diagnostiques, aucune cause n’est identifiée dans encore 20 % des hémorragies cérébrales.
Conséquences du retard diagnostique et de prise en charge
Tout comme pour les AVC néonataux, le pronostic des enfants ayant présenté un AVC varie d’une étude à l’autre en fonction de différentes considérations méthodologiques. Néanmoins, la mortalité a été évaluée entre 18 et 23 %(1).
Certains facteurs de mauvais pronostic ont été identifiés comme un âge de début jeune, une cause cardio-embolique, la présence de facteurs de risque multiples, des troubles de conscience, un AVC hémorragique ou une transformation hémorragique d’un infarctus, des crises comitiales ou une hémiplégie persistante(1). Des séquelles neurologiques sont constatées dans 41 à 54 % des cas(1) et sont relativement spécifiques à l’enfant, avec l’aphasie qui n’apparaît que chez le jeune ayant déjà acquis l’écriture au moment de l’AVC, l’épilepsie, beaucoup plus fréquente que chez l’adulte (30 % versus 15 %) et la dystonie de l’hémicorps déficitaire(2,5). Enfin, le risque de récidive n’est pas négligeable, puisqu’une récurrence est constatée chez 20 à 40 % des patients(1).
Stratégie
Le leitmotiv des professionnels de l’urgence doit être comme pour l’adulte :
- le bon malade : éligible éventuellement pour une fibrinolyse ;
- au bon moment : jusqu’à 4 heures 30 ;
- au bon endroit : dans une unité neurovasculaire.
Tous les enfants victimes d’un AVC doivent être pris en charge par le SAMU pour accéder le plus rapidement possible à une unité de soins intensifs neurovasculaire dont l’efficacité est largement démontrée(1) par les soins prodigués de façon pluridisciplinaire centrée autour du pédiatre, du neurologue et du radiologue.
Actuellement, aucun essai thérapeutique n’a évalué les traitements de phase aiguë de l’infarctus cérébral chez l’enfant. Les connaissances sur le sujet proviennent majoritairement de cas cliniques isolés, exposant à un biais de publication évident, ou encore de petites séries observationnelles de cas. La thrombolyse intraveineuse par rt-PA semble réalisable et sûre chez les enfants victimes d’un infarctus cérébral d’origine artériel (classe III, niveau C)(2,17) (figure). Néanmoins, ce traitement doit être réservé aux centres de référence inter-régionaux, tel que le prévoit le plan AVC. L’approche endovasculaire peut être également discutée, mais là encore les données sont très limitées(18). Un essai thérapeutique à venir permettra peutêtre de répondre aux interrogations(19).
Une anticoagulation à la phase aiguë doit être envisagée en cas de risque de récidive précoce. Contrairement à l’adulte, il est licite de placer les enfants sous héparinothérapie le temps de l’établissement du diagnostic, car les causes les plus fréquentes à cet âge sont les vasculopathies, les cardio-embolies ou les coagulopathies(2).
La prise en charge des hémorragies cérébrales de l’enfant dépend de la cause retrouvée. Ainsi, il est recommandé de corriger les déficits en facteurs de coagulation le cas échéant et de traiter de manière adéquate les anomalies vasculaires ayant saigné. Plus généralement, un contrôle de la tension artérielle, des crises comitiales et de la pression intracrânienne doit être envisagé (classe I, niveau C)(2).
Conclusion
L’enfant peut être victime d’AVC dont les causes et le pronostic sont très différents de ceux observés chez l’adulte, et très spécifiques, notamment chez les plus jeunes. La plasticité cérébrale importante à cet âge pourrait expliquer des évolutions cliniques parfois inattendues. Néanmoins, la frontière qui existe entre l’AVC de l’adolescent et de l’adulte jeune n’est que théorique, les causes étant souvent les mêmes à ces âges de la vie.
Cela justifie une bonne connaissance de cette pathologie, afin que les neurologues puissent partager leurs compétences avec les pédiatres dans la gestion de la phase aiguë et des complications des AVC du nouveau-né et de l’enfant.
Figure 1. Maladie de Moya-Moya.
Figure 2. IRM cérébrale d’un enfant de 14 ans présentant depuis 3 heures un déficit moteur brachio-facial droit, avec aphasie survenus brutalement. L’examen montre un hypersignal du territoire sylvien gauche sur la séquence diffusion (A), un ralentissement circulatoire sur ce même territoire sans lésion parenchymateuse associée sur la séquence T2-FLAIR (B) et une occlusion du segment M1 de l’artère sylvienne gauche sur la séquence Time-of- Flight (ToF) (C). Il s’agit donc d’un infarctus cérébral en cours de constitution. Une thrombolyse intraveineuse par rt-PA est alors pratiquée et conduit à une récupération clinique totale 2 heures après le début du traitement. L’IRM cérébrale de contrôle montre une séquelle ischémique minime lenticulaire gauche sur la séquence T2-FLAIR (D) et une reperméabilisation complète de l’artère sylvienne gauche sur la séquence ToF (E).
"Publié dans Pédiatrie Pratique"
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :