Publié le 14 oct 2007Lecture 23 min
L’évaluation neurologique du prématuré en réanimation
Jean-Marc RETBI, Service de Néonatologie et Réanimation Néonatale, CH de Saint-Denis
Il naît chaque année en France 55 000 à 60 000 prématurés (terme < 37 semaines d’aménorrhée [SA]), dont environ 20 % sont de grands prématurés (< 33 SA). Ce sont ces derniers qui ont le risque le plus élevé de séquelles neuropsychiques. Il est à présent bien démontré qu’un certain nombre de ces séquelles est consécutif à des accidents cérébraux survenus en période périnatale et qu’il est possible de détecter ces accidents dès les premiers jours de vie. Cet article est une mise au point sur l’évaluation neurologique (EN) du prématuré hospitalisé en unité de réanimation avec « en toile de fond » le pronostic neurologique à long terme chez ce type d’enfant. Il rappellera des notions de base, puis envisagera successivement les accidents cérébraux propres au grand prématuré, ainsi que les moyens et la stratégie de l’EN du prématuré en réanimation.
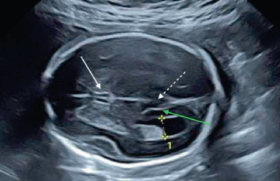
Quelques notions de base - L’hémorragie intraventriculaire (HIV) et la leucomalacie périventriculaire (LPV) sont les accidents cérébraux caractéristiques du prématuré (Larroche) (1). Elles surviennent dans des zones et des périodes de vulnérabilité spécifiques du cerveau en développement. En revanche, l’encéphalopathie hypoxique-ischémique et les infarctus cérébraux affectent plutôt le nouveau-né à terme. - Soixante-dix pour cent à 90 % des « déficiences sévères » des exprématurés ont un substratum anatomique périnatal du type HIV de haut grade, LPV, etc. (le terme de « déficiences sévères » désigne « les paralysies cérébrales », les retards mentaux avec QI < 50, les surdités profondes et les cécités, reconnus généralement avant l’âge de 2 ans et relativement fixés).- L’évaluation neurologique (EN) du prématuré permet de détecter la LPV, l’HIV, etc., et donc, de prévoir l’état neuro logique à 2 ans. En revanche, l’absence de LPV et de HIV ne présage pas du devenir à long terme (6-7 ans) de l’exprématuré (possibilité de troubles émotionnels et comportementaux, et de troubles cognitifs et des apprentissages qui deviennent manifestes au moment de la scolarisation) (5). - La gravité des lésions cérébrales du prématuré peut faire discuter un « arrêt de vie » en période néonatale. Ce problème éthique est abordé différemment selon les pays. En France, la Fédération nationale des pédiatres néonatologistes recommande de « résoudre au cas par cas le problème posé », en considérant tout nouveau-né comme « un patient à part entière » (6). - L’unité de réanimation néonatale est le cadre de l’EN du prématuré. La politique de périnatalité, appliquée en France depuis l’an 2000, vise à faire naître 80 % des grands prématurés (les « inborn ») dans un centre périnatal de niveau III (maternité + néonatologie avec réanimation) et à faire prendre en charge initialement presque 100 % de ces enfants dans une unité de réanimation néonatale. Les principaux tableaux anatomo-cliniques Les deux grands tableaux anatomocliniques des lésions cérébrales propres à la prématurité sont l’HIV et la LPV (1-4). Hémorragie intraventriculaire (HIV) L’HIV proprement dite est définie par la présence de sang dans les ventricules latéraux du cerveau. On lui rattache l’hémorragie sous-épendymaire qui la précède toujours et l’hémorragie parenchymateuse qui lui est parfois associée. C’est typiquement une affection du prématuré de moins de 35 SA. Son incidence est inversement proportionnelle à l’âge gestationnel. Chez le grand prématuré, elle a pu atteindre 50 % dans des séries anciennes, mais elle tend à diminuer ces dernières années. Histoire naturelle Le saignement débute dans la zone germinative, qui n’est pas encore totalement épuisée en cellules gliales et qui contient des capillaires et des veinules. Il se produit, en règle générale, à la partie antérieure de cette zone, au-dessus de la tête et de la partie antérieure du corps du noyau caudé, et il est plus souvent bilatéral qu’unilatéral. Il peut s’arrêter à ce stade (hémorragie sousépendymaire), ou se poursuivre et se déverser dans le ventricule latéral (hémorragie intraventriculaire). Si l’HIV est abondante, le sang se répand dans tout le système ventriculaire, puis dans l’espace sous-arachnoïdien (via les trous de Luschka et de Magendie). Une dilatation ventriculaire apparaît dans un tiers des HIV et évolue vers une hydrocéphalie posthémorragique, s’il y a une obstruction au niveau du toit du 4e ventricule ou de l’aqueduc de Sylvius, ou un défaut de résorption du LCR. Dans certains cas, il existe en plus de l’HIV, un infarcissement hémorragique du parenchyme périventriculaire. Le saignement se produit au cours des trois premiers jours de vie. Il apparaît le plus souvent dans les heures qui suivent lanaissance, voire dans les heures qui la précèdent et atteint son maximum vers 5 jours. Une hémorragie plus tardive peut être due à des troubles de l’hémostase. L’hydocéphalie non communicante, par « feutrage » du toit du 4e ventricule, devient manifeste vers 3 semaines de vie. La classification de Papile En se basant sur les résultats de la tomodensitométrie cérébrale, Papile et coll. (7) ont proposé une classification des HIV en quatre stades : - grade I : hémorragie sous-épendymaire ; - grade II : HIV sans dilatation ventriculaire ; - grade III : HIV avec dilatation ventriculaire, sans préjuger du mécanisme de la dilatation ; - grade IV : HIV avec hémorragie périventriculaire (en fait,il s’agit d’un infarctus hémorragique). Cette classification fait de l’infarctus hémorragique un stade de l’HIV et confère à l’hydrocéphalie – en ne la mentionnant pas – un statut de complication. Pathogénie L’hémorragie est due à un saignement capillaire dans le territoire de la veine opto-striée. On pense que la rupture capillaire est consécutive à la perte de l’autorégulation cérébrale et aux variations brusques du débit sanguin et de la pression cérébrale. L’hypercapnie pourrait favoriser l’HIV en entraînant une vasodilatation cérébrale. Des à-coups tensionnels peuvent surtout déclencher une HIV, en débordant l’autorégulation cérébrale. Les grandes séquelles de l’HIV sont en rapport avec l’apparition d’une hydrocéphalie posthémorragique ou la destruction de parenchyme cérébral. L’hémorragie de la zone germinative ellemême ne lèse que des précurseurs des cellules gliales. Les grandes séquelles de l’HIV sont en rapport avec l’apparition d’une hydrocéphalie posthémorragique ou la destruction de parenchyme cérébral. Le principal facteur de risque d’HIV est la grande prématurité. En pratique, tout prématuré né avant 35 SA révolues est à risque élevé d’HIV. Le sexe masculin, l’accouchement par voie basse (versus la césarienne), une maladie des membranes hyalines, une infection materno-foetale augmentent le risque. Clinique et échographie L’HIV du prématuré est silencieuse, sauf dans trois cas : - quand elle est très abondante (« inondation ventriculaire »). Elle se manifeste alors par une brusque détérioration de l’état cardiorespiratoire et neurologique, associée à une déglobulisation aiguë ; - quand elle est associée à un infarctus hémorragique. Elle peut se traduire par une instabilité cardiorespiratoire et des convulsions, en général « subtiles », qui sont authentifiées par l’EEG ; - quand elle se complique d’hydrocéphalie. Elle entraîne une augmentation anormale du périmètre crânien et une disjonction de toutes les sutures. L’échographie transfontanellaire (ETF) est le meilleur examen pour diagnostiquer le saignementet surveiller son évolution. La dilatation ventriculaire est appréciée par l’augmentation de l’index ventriculaire, mesuré sur la coupe coronale passant par les trous de Monro. L’échographie transfontanellaire (ETF) est le meilleur examen pour diagnostiquer le saignement et surveiller son évolution. Pronostic Le pronostic des HIV dépend de leur stade, l’hydrocéphalie étant mise à part. L’hémorragie sous-épendymaire et l’HIV sans dilatation ventriculaire ont un bon pronostic vital et psychomoteur. L’HIV avec dilatation ventriculaire notable entraîne moins de 10 % de décès, mais 30 à 40 % de paralysies cérébrales et de troubles cognitifs. Une hémorragie intraparenchymateuse associée fait monter la mortalité à 80 % et les séquelles neurologiques et cognitives à plus de 90 % chez les survivants. L’hydrocéphalie posthémorragique donne une mortalité élevée et deux tiers de séquelles sévères chez les survivants. Traitement curatif et prévention Le traitement d’une HIV se limite à peu près à une « réanimation d’attente » en cas d’inondation ventriculaire ou d’hémorragie périventriculaire. La prise en charge d’une hydrocéphalie posthémorragique est difficile. Il y a intérêt à « temporiser » jusqu’au voisinage du terme en surveillant le périmètre crânien et les dimensions des ventricules cérébraux. Quand la temporisation n’est pas possible, les deux options neurochirurgicales sont la dérivation externe et la mise en place d’un réservoir sous-cutané, relié à un drain intraventriculaire. Reste la prévention primaire. Sur le versant obstétrical, quand une prématurité spontanée ou induite apparaît inévitable, la corticothérapie anténatale et un accouchement « non traumatisant » sont recommandés. Sur le versant pédiatrique, il importe de contrôler la pCO2 en venti lation assistée et d’éviter les à-coups tensionnels, en limitant le remplissage vasculaire et l’utilisation de bicarbonate de soude semi-molaire, en luttant contre les gestes agressifs et douloureux et en interdisant la kinésithérapie pendant les trois premiers jours de vie. Leucomalacie périventriculaire (LPV) La LPV est caractérisée par une nécrose focale de la substance blanche périventriculaire, survenant à un moment où cette substance n’est pas encore myélinisée. Le terme de « leucomalacie » rappelle les petites « taches blanches » qu’on peut voir sur des coupes de cerveaux fixés. La LPV est exclusivement une affection du grand prématuré. Son incidence est estimée à 5- 10 % de tous les prématurés de moins de 33 SA. Elle est plus élevée chez les grands prématurés nés dans un contexte de chorioamniotite et chez les jumeaux monochoriaux survivants. Histoire naturelle La « fenêtre vulnérable » du cerveau vis-à-vis de la LPV se situe entre 24 et 34 SA. Elle correspond à la présence des progéniteurs tardifs des oligodendrocytes dans la substance blanche périventriculaire et dans le corps calleux. Le début est habituellement périnatal, mais il peut être aussi anténatal ou postnatal tardif (extrême prématurité, entérocolites ulcéronécrosantes). Le foyer de nécrose de coagulation de la substance blanche est l’aspect histologique le plus précoce ; une fragmentation des axones peut y être mise en évidence. Il devient rapidement le siège d’une réaction cellulaire polymorphe, faite de cellules microgliales, puis de macrophages et d’astrocytes. Il va évoluer soit vers une « lyse tissulaire » et l’apparition de cavités (ou kystes), soit vers une « cicatrice gliale » faite de gliose avec absence localisée de myéline. De la nécrose au début de la cavitation/ gliose, il s’écoule une huitaine de jours. Les lésions sont certainement plus diffuses et touchent aussi les neurones de la sous-plaque et des noyaux gris centraux. À long terme, il y aura une atrophie de la substance blanche, avec démyélinisation. Classiquement, les foyers de LPV sont disséminés d’avant en arrière dans le centre semiovale, avec une prédominance au niveau du bras postérieur de la capsule interne (où passe le faisceau cortico-spinal), et des radiations optiques. Classification Le processus de cavitation, qui est caractéristique de la LPV mais inconstant, sert à classer les LPV. D’après les résultats de l’ETF, on distingue : - la LPV avec cavitation (ou LPV « kystique »), qui passe du stade d’hyperéchogénicité à celui de cavitation (en échographie) en 14 à 21 jours ; - et la LPV sans cavitation, où il n’y a qu’une hyperéchogénicité persistante. On parle de « porencéphalie » quand les cavités sont nombreuses et volumineuses. Pathogénie La LPV a d’abord été considérée comme une forme d’encéphalopathie hypoxique-ischémique propre au grand prématuré. Dans la théorie dite du « dernier pré carré », toute diminution du débit sanguin cérébral, en l’absence d’une autorégulation efficace, expose à l’ischémie la région latéro-ventriculaire de la substance blanche, une zone qui est pauvre en anastomoses artérielles et traversée par les fibres du faisceau cortico-spinal destinées aux membres inférieurs. De façon symétrique à l’HIV, les facteurs déclenchants deviennent potentiellement l’hypotension artérielle et l’hypocapnie. La théorie inflammatoire cadre plus souvent avec la clinique. Elle fait jouer un rôle prépondérant aux macrophages et à la microglie, et aux cytokines pro-inflammatoires à savoir le tumor necrosis factor α et les inter leukines 2 et 6. Les facteurs déclenchants sont alors l’infection et la réaction inflammatoire. Dans les deux cas, la « cible cellulaire » est l’oligodendrocyte ouplus précisément son progéniteur tardif qui ne fabrique pas de myéline. La mort cellulaire peut être de nature ischémique ou apoptotique. Le processus qui aboutit à cette mort suscite de nombreuses recherches dans trois grandes directions : le glutamate et la cascade excitotoxique ; les radicaux libres, qu’ils dérivent de l’oxygène et entraînent la peroxydation des lipides cérébraux ou du monoxyde d’azote et provoquent la formation de nitrotyrosine ; et les cytokines pro-inflammatoires, déjà mentionnées. Pour expliquer les séquelles neurologiques, on invoque l’absence de migration des progéniteurs et des astrocytes à destination neuronale, du fait de l’obstacle formé par la cicatrice gliale, l’interruption et le défaut de myélinisation des axones, la destruction des neurones de la sous-plaque. Facteurs de risque Comme pour l’HIV, le principal facteur de risque est la grande prématurité. En pratique, tout prématuré, né avant 33 SA révolues,est à risque élevé de LPV. Les facteurs de risque ≥ 10 % pour un prématuré < 33 SA sont la chorioamniotite, la rupture prématurée des membranes (l’association des deux fait monter le risque à 22 %), la gémellité monochoriale (avec anastomosesplacentaires), et les métrorragies pré- et perpartum. Clinique et Échographie La LPV est toujours silencieuse en période néonatale, ce qui fait que sa détection ne peut être qu’échographique. L’EEG peut toutefois aider quand il enregistre des pointes positives rolandiques (PPR), des « images en opposition de phase » (ou en miroir) sur les régions rolandiques, visibles dans un montage longitudinal. Dans la forme habituelle de LPV, les PPR apparaissent dès les premiers jours de vie. L’ETF est le seul examen permettant de diagnostiquer une LPV etde la suivre. La LPV débutante se traduit par une ou plusieurs plages d’hyperéchogénicité juste en dehors du ventricule latéral. Il faut alors « guetter » l’apparition de kystes au sein de ces plages pendant plusieurs semaines. On dit qu’une hyperéchogénicité est persistante quand elle dure plus de 10 jours, sans qu’apparaisse une cavitation. Pronostic La LPV est la grande pourvoyeuse de paralysies cérébrales chez l’exprématuré, mais il faut séparer le pronostic des LPV cavitaires de celui des hyperéchogénicités persistantes. Le pronostic neurologique à 2 ans des LPV cavitaires peut être énoncé clairement à partir du bilan des lésions en période néonatale. Globalement, plus de 90 % des grands prématurés atteints de LPV kystique ont des séquelles neurologiques à 2 ans. Les lésions pariétales et pariéto-occipitales bilatérales donnent une diplégie spastique des membres inférieurs (ou maladie de Little) et une dyspraxie des membres supérieurs quand les kystes ont une extension antério-postérieure (sur une coupe sagittale) < 2 cm ; et une quadriplégie, un retard mental et un strabisme quand les kystes ont une extension > 2 cm. Les lésions pariétales et pariéto-occipitales vraiment unilatérales, qui sont souvent étendues, donnent une hémiplégie croisée. Les lésions frontales isolées n’entraînent pas de séquelles apparentes à 2 ans. Les lésions occipitales isolées entraîneraient des troubles de la vision et de l’oculomotricité. Globalement, plus de 90 % des grands prématurés atteints de LPV kystique ont des séquelles neurologiques à 2 ans. Le pronostic des hyperéchogénicités persistantes doit être formulé avec l’aide de l’IRM précoce. Globalement, 60 % des enfants ayant eu une hyperéchogénicité persistante n’ont pas de séquelles neurologiques à 2 ans ; 20 % ont des séquelles motrices « modérées » ; 20 % des anomalies neurologiques transitoires au cours de la première année de vie. Si l’IRM faite à 1 mois montre un hypersignal périventriculaire en T1, ce qui se voit une fois sur deux, des séquelles motrices sont constatées dans 70 % des cas, surtout pour une maladie de Little. Si l’IRM est normale, dans 95 % des cas, l’examen neurologique est normal à 2 ans. L’apparition retardée (hors HIV) d’une dilatation ventriculaire assombrit le pronostic, parce qu’elle témoigne d’une atrophie de la substance blanche.Traitement curatif et prévention La poursuite des soins de réanimation est contestable, si la LPV est bilatérale, étendue. À titre préventif, trois mesures obstétricales sont importantes devant une menace d’accouchement prématuré avant 34 SA : la corticothérapie anténatale, l’antibiothérapie maternelle et le transfert in utero. En cas de chorioamniotite, après rupture de la poche des eaux, il n’y a aucun intérêt à essayer de prolonger la grossesse ; au contraire, une extraction par césarienne peut se discuter. Il faut éviter en anté- et en postnatal certains médicaments en solution contenant des sulfites comme stabilisateurs (dexaméthasone, dopamine, etc.), parce que ceux-ci ont une toxicité cérébrale chez le grand prématuré. En ventilation assistée, il faut éviter l’hypocapnie (une pCO2 < 25 mmHg) qui est corrélée à la survenue d’une LPV. Il faut aussi dépister et compenser l’hypothyroxinémie transitoire du grand prématuré, qui est corrélée au devenir neuropsychique. Enfin quand les lésions de LPV sont constituées, il reste à en limiter les conséquences. L’installation de l’enfant doit en particulier éviter les « attitudes vicieuses » comme l’abduction des hanches. Une prise en charge adaptée, impliquant un suivi prolongé de l’enfant en collaboration étroite avec ses parents, doit être « démarrée » à la sortie de l’unité de réanimation. À côté de l’HIV, il faut citer les hémorragies de la fosse cérébrale postérieure qui peuvent être intraou péricérébelleuses, les méningites, les foetopathies infectieuses, etc. Mais en définitive, il y a schématiquement chez le (grand) prématuré en réanimation trois tableaux anatomocliniques qui comportent un risque élevé de séquelles neuropsychiques : l’hémorragie intra- et périventriculaire (c’est à dire l’HIV avec un infarctus hémorragique, l’hydrocéphalie posthémorragique et la leucomalacie périventriculaire). L’installation souvent insidieuse des deux premiers et silencieuse du troisième impose de les rechercher systématiquement, par ETF, dès la naissance. Stratégie de l’évaluation neurologique en réanimation Quels moyens ? Comme cela a été dit chemin faisant,l’examen neurologique est souvent peu parlant en période néonatale. Habituellement, « la clinique ne reprend ses droits » que lorsque le nouveau-né est parvenu au voisinage du terme théorique (40-41 SA)1. Un examen neurologique de maturation normal est alors rassurant (Amiel-Tison, Dubowitz). À l’inverse, l’observation de « mouvements généraux » atypiques est inquiétante (Precthl, Cioni). La mise en évidence d’une réaction latérale d’abduction (Grenier) et de schèmes neuromoteurs normaux (Le Métayer) permet de dire aux parents que « leur enfant marchera à 2 ans »…, mais on est sorti de la période de réanimation. L’hématocrite fait suspecter une hémorragie intracrânienne quand il chute brusquement de façon nette et inexpliquée. La ponction lombaire est à éviter en raison de sa mauvaise tolérance et de ses difficultés (PL blanche ou traumatique). Cependant, chez le prématuré, une hémorragie sous-arachnoïdienne est presque toujours satellite d’une HIV. L’EEG est après l’échographie transfontanellaire (ETF) un bon moyen d’EN du prématuré (Dreyfus-Brisac1). Il doit être acquis « au lit du malade » et interprété par un spécialiste compétent. Certains tracés de fond sont péjoratifs (asymétrie et asynchronie des ondes lentes ; inactivité) ; les PPR sont un signe d’ischémie périventriculaire. L’échographie cérébrale (ou ETF) est le meilleur moyen d’EN du prématuré en réanimation. Elle est faite au lit du malade avec un appareil mobile performant et une sonde de fréquence élevée par un néonatologiste expérimenté. La fenêtre de la fontanelle antérieure permet de réaliser des coupes du cerveau à peu près coronales et sagittales, mais la superficie du cerveau et la fosse cérébrale postérieure sont difficiles à explorer. L’IRM cérébrale « précoce » vient compléter l’ETF. L’examen oculaire est difficile à réaliser, mais les fonds d’yeux doivent être contrôlés vers 36 SA pour détecter une rétinopathie du prématuré. Quant aux tests auditifs et à l’étude des potentiels évoqués somesthésiques, ils ne sont pas réalisables avant plusieurs mois. Stratégie d’exploration et de surveillance par l’imagerie cérébrale. En définitive, le cerveau du prématuré doit être exploré systématiquement par échographie4,8. Chez le grand prématuré (< 33 SA), il faut faire au minimum trois ETF pendant le premier mois de vie. - La première ETF doit être faite dans les 3 premiers jours. L’échographie morphologique précoce recherche une hyperéchogénicité anormale, sous-épendymaire, intraluminale, parenchymateuse et/ou des noyaux gris centraux. Elle permet d’affirmer une hémorragie de la zone germinative, une HIV (avec parfois une dilatation ventriculaire débutante) et une hémorragie intra- et périventriculaire, mais pas une LPV, sauf présence exceptionnelle à cet âge de microkystes en son sein. En effet, si une plage d’hyperéchogénicité latéroventriculaire isolée fait craindre une LPV, d’autant plus qu’elle est intense, hétérogène et étendue, elle peut aussi régresser les jours suivants (« hyperécho - génicité transitoire »). Quand l’échographie morphologique semble normale, il est intéressant de la compléter par un Doppler pulsé de l’artère cérébrale antérieure. - La deuxième ETF doit être faite entre 7 et 10 jours de vie. Elle peut : - révéler la survenue d’une HIV, alors que le première ETF était normale ou ne montrait qu’une hémorragie sous-épendymaire ; - montrer l’apparition d’une dilatation ventriculaire ou d’un infarctus hémorragique sur une HIV préexistante ; - confirmer la réalité d’une hyperéchogénicité périventriculaire, en raison de sa persistance ou de son hétérogénéïté (annonciatrice de kystes) ; - affirmer l’existence d’une autre lésion (par ex. : des noyaux gris centraux). Beaucoup de néonatologistes considèrent que tout prématuré, qui a eu une souffrance cérébrale périnatale, doit subir une IRM vers 1 an. Si les deux premières ETF sont normales, une troisième et dernière ETF à 1 mois est suffisante. Cependant, tout événement intercurrent (infection, entérocolite ulcéronécrosante, etc.), tout incident de parcours justifieront une ETF supplémentaire. Si les premières ETF sont anormales, des examens échographiques séquentiels s’imposent jusqu’au voisinage du terme. La surveillance d’une HIV aura pour but de détecter une dilatation ventriculaire éventuelle et d’apprécier son évolutivité morphologique (hydrocéphalie). Le Doppler peut mettre en évidence une augmentation de l’indice de résistance, qui est corrélée avec l’existence d’une hypertension intracrânienne. La surveillance d’une LPV pourra montrer l’apparition de macroou plus fréquemment de microkystes, la persistance prolongée d’une hyperéchogénicité périventriculaire ou celle d’une ventriculomégalie. La ventriculomégalie donne un aspect arrondi aux cornes frontales (sur les coupes coronales) ; elle est stable, mais peut s’accompagner d’un élargissement acquis des espaces péricérébraux. C’est dans ce contexte que se discute l’indication de l’IRM cérébrale dite « précoce », réalisée entre 1 mois de vie, et le terme théorique. L’IRM précoce est notamment contributive dans l’hydrocéphalie posthémorragique et l’hyperéchogénicité périventriculaire prolongée, ainsi que dans les lésions des noyaux gris centraux et les hémorragies de la fosse cérébrale postérieure. ,Passée la période néonatale, l’IRM devient l’examen de référence pour l’examen du cerveau. Beaucoup de néonatologistes considèrent que tout prématuré qui a eu une souffrance cérébrale périnatale doit subir une IRM vers 1 an. Les techniques de perfusion et de diffusion en sont à leurs débuts en pédiatrie. Le pronostic de la prématurité s’est déplacé des poumons au cerveau. Conclusion Quand on considère l’évolution de la nature et de l’organisation des soins périnataux, et de leurs résultats, au cours des vingt dernières années, deux grandes tendances se dégagent. Grâce aux progrès des traitements à visée respiratoire (corticothérapie anténatale, surfactants pulmonaires, ventilation par OHF), le pronostic de la prématurité, notamment celui de la grande prématurité, s’est déplacé des poumons au cerveau. L’objectif du néonatologiste n’est plus de faire survivre le prématuré, mais de faire survivre un prématuré en bon état neurologique. Les accidents neurologiques ont aussi changé en fréquence et gravité. L’incidence des HIV sévères a nettement diminué. Relativement, la LPV est actuellement la principale pourvoyeuse de séquelles neurologiques à 2 ans, mais l’incidence des formes kystiques étendues a aussi diminué, semble-t-il. Ceci est surtout rapporté à l’amélioration de la qualité des soins obstétricaux et néonataux, concernant leur nature et leur organisation. En effet, à ce jour, il n’y a pas de traitement curatif et les tentatives de neuroprotection sont infructueuses.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :