Publié le 19 fév 2009Lecture 12 min
Quand l’épilepsie signe une tumeur cérébrale
S.DUPONT, Unité d'épilepsie, Hôpital de la Pitié-Salpêtriere, APHP, Paris INSERM U739, Faculté de Médecine Pitié-Salpêtriere, Paris Faculté de Médecine Paris VI Pierre et Marie Curie, Paris
L’épilepsie est une manifestation fréquente, le plus souvent inaugurale, des tumeurs cérébrales. Parmi ces dernières, les tumeurs développementales, les gliomes de bas grade, les tumeurs hémorragiques et les métastases multiples sont les plus à risque d’être à l’origine de crises épileptiques. Ces crises en rapport avec des tumeurs cérébrales sont des crises partielles (simples, complexes et/ou secondairement généralisées). L’absence de corrélation anatomo-clinique évidente ne doit pas faire récuser la tumeur comme étant à l’origine de l’épilepsie, mais doit faire évoquer la possibilité d’un foyer épileptogène secondaire.
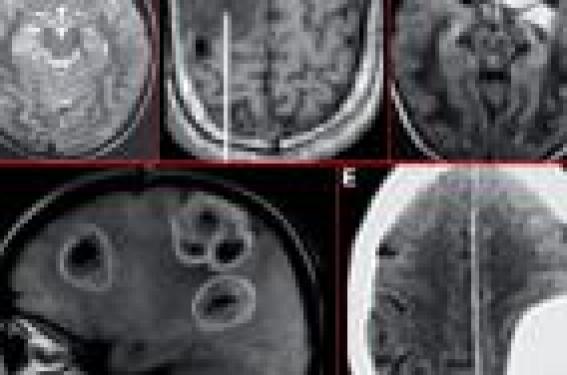
Épidémiologie et facteurs de risque d’épilepsie au cours des tumeurs cérébrales L’épilepsie est une manifestation fréquente chez les patients porteurs de tumeurs cérébrales primitives ou secondaires avec une fréquence de crises comitiales oscillant en moyenne entre 30 et 50 % (1). Parallèlement, les tumeurs cérébrales sont une cause rare d’épilepsie avec une incidence estimée à 4 % chez les patients souffrant d’épilepsie (2). Dans la majorité des cas, les crises sont inaugurales et vont amener à la découverte de la lésion cérébrale ; des crises plus tardives émaillant l’évolution de la maladie peuvent également se rencontrer, mais sont plus rares. Pour les patients souffrant d’une tumeur cérébrale sans épilepsie, le risque ultérieur de développer des crises comitiales oscille entre 20 et 45 % selon les séries. Le caractère inaugural des crises semble de mauvais pronostic pour le contrôle ultérieur de l’épilepsie et est considéré comme un facteur de risque de pharmacorésistance3. Les facteurs de risque de développement ultérieur d’une épilepsie en cas de tumeur cérébrale sont principalement : - le type anatomo-pathologique de la tumeur cérébrale (3) : les tumeurs cérébrales les plus à risque de crises sont les tumeurs développementales (tumeur dysembryoplasique neuroépithéliale (DNET), gangliogliomes), les tumeurs primitives à développement lent (astrocytomes, gliomes de grade 2), les méningiomes, les tumeurs hémorragiques (mélanomes) et les métastases multiples (figure 1) ; - la localisation de la tumeur : une localisation corticale, notamment rolandique, constitu, logiquement un facteur de risque d’épilepsie (figure 2). Figure 1. Neuropathie optique avec augmentation du volume musculaire. A. DNET. B. Astrocytome. C. Oligodendrogliome. D. Métastases multiples. E. Méningiome. Figure 2. Neuropathie optique avec augmentation du volume musculaire. Clinique des crises d’épilepsie en rapport avec une tumeur cérébrale Les crises d’épilepsie en rapport avec une tumeur cérébrale sont des crises partielles (simples, complexes et/ou secondairement généralisées) (5). Avec l’évolution et la mise en route des traitements antiépileptiques, les crises deviennent majoritairement partielles simples et complexes, avec relativement peu de généralisations secondaires. L’absence de corrélation anatomoclinique évidente ne doit pas faire récuser la tumeur comme étant à l’origine de l’épilepsie, mais doit faire évoquer la possibilité d’un foyer épileptogène secondaire. L’absence de corrélation anatomo-clinique évidente ne doit pas faire récuser la tumeur comme étant à l’origine de l’épilepsie. Prise en charge thérapeutique Traitement préventif • La découverte d’une tumeur cérébrale chez un patient libre de crises ne doit pas amener à la mise en route d’un traitement préventif antiépileptique. À ce jour, aucune étude n’a mis en évidence de rôle neuroprotecteur d’un traitement antiépileptique prophylactique. Douze études répondant à des niveaux d’évidence I et II ont été répertoriées dans une métaanalyse récente (5). Les effectifs de patients dans la totalité des études recensées étaient relativement faibles (entre 36 et 247 patients), trois médicaments antiépileptiques ont principalement été étudiés versus placebo (valproate de sodium, phénytoïne et phénobarbital) chez des patients souffrant majoritairement de métastases cérébrales, de gliomes et de mélanomes. Aucune étude n’a montré un bénéfice statistiquement significatif à mettre en route un traitement antiépileptique prophylactique chez ce type de patients. Dans tous les cas, le risque de développement ultérieur d’une épilepsie était identique sous traitement antiépileptique et sous placebo. • Pour les patients non épileptiques bénéficiant de l’exérèse chirurgicale de leur tumeur cérébrale, la mise en route d’un traitement antiépileptique prophylactique dans la période post-opératoire précoce est plus controversée. Une étude randomisée (carbamazépine, phénytoïne ou placebo) portant sur 276 patients n’a pas retrouvé d’effet statistiquement significatif en faveur de la couverture antiépileptique (6). Une métaanalyse des quelques études randomisées de la littérature portant sur la prophylaxie antiépileptique dans la période post-opératoire précoce a retrouvé une tendance non statistiquement significative en faveur du traitement antiépileptique (7). Même si la majorité des études (pour la plupart rétrospectives et non contrôlées) rapportent un effet bénéfique d’un traitement prophylactique dans la période post-opératoire précoce (période de l’intervention et première semaine post-opératoire) (8), les deux seules études randomisées (9,10) ne montrent pas d’intérêt à long terme du traitement prophylactique pour prévenir la survenue de crises plus tardives, même si elles retrouvent un bénéfice significatif dans la période post-opératoire précoce. Des études randomisées portant sur de larges effectifs de patients seraient nécessaires pour pouvoir dégager des recommandations claires et admises de tous. Aucune étude n’a mis en évidence de rôle neuroprotecteur d’un traitement antiépileptique prophylactique. Recommandations de l’Académie américaine de neurologie (AAN) Chez les patients nouvellement diagnostiqués comme porteurs d’une tumeur cérébrale, les médicaments antiépileptiques ne sont pas efficaces pour prévenir la survenue de crises. Du fait de leur manque d’efficacité et de leurs effets secondaires potentiels, les traitements antiépileptiques ne doivent pas être utilisés en routine de manière prophylactique chez des patients nouvellement diagnostiqués comme porteurs d’une tumeur cérébrale. Chez les patients porteurs d’une tumeur cérébrale, n’ayant pas présenté de crises, il est recommandé de diminuer puis d’arrêter le traitement antiépileptique après la première semaine postopératoire, en particulier chez les patients médicalement stables et chez ceux présentant des effets secondaires des médicaments antiépileptiques. Traitement de l’épilepsie associée à une tumeur cérébrale En cas d’épilepsie avérée, la stratégie thérapeutique va être fonction du type de tumeur cérébrale : - pour les tumeurs développementales, connues pour leur potentiel évolutif faible ou absent, la priorité sera donnée au traitement de l’épilepsie. Le caractère souvent pharmacorésistant de ces tumeurs devra amener à considérer rapidement, si la localisation de la tumeur le permet, l’option d’un traitement chirurgical curatif de l’épilepsie ; - pour les tumeurs ayant un potentiel évolutif, priorité sera donnée au traitement antitumoral. Trois facteurs seront alors prioritairement à prendre en compte pour le choix du traitement antiépileptique : - les éventuelles interactions entre le traitement antiépileptique et le traitement oncologique en cours ou programmé ; - l’efficacité du traitement antiépileptique ; - la tolérance du médicament antiépileptique. Interactions entre le traitement antiépileptique et le traitement oncologique La co-administration d’un traitement inducteur enzymatique et d’une chimiothérapie diminue dans la plupart des cas l’efficacité de cette dernière. Ainsi, les inducteurs du cytochrome P450 3A4 (comme la phénytoïne, la carbamazépine ou le phénobarbital) sont-ils connus pour augmenter significativement le métabolisme de nombreux agents utilisés dans les chimiothérapies comme le CPT11, le paclitaxel ou d’autres molécules plus récentes comme les inhibiteurs de la tyrosine kinase. À l’inverse, certaines chimiothérapies (cisplatine, vinplastine, carbiplastine...) peuvent diminuer l’efficacité des traitements antiépileptiques co-prescrits comme cela a été démontré avec la phénytoïne, la carbamazépine et le valproate de sodium (11). Il a, par ailleurs, été suggéré que certains médicaments antiépileptiques, en particulier la phénytoïne et le phénobarbital, pouvaient altérer la réponse immunitaire cellulaire. La co-administration d’un traitement inducteur enzymatique et d’une chimiothérapie diminue dans la plupart des cas l’efficacité de cette dernière. Cas particulier de la phénytoïne La phénytoïne est un médicament inducteur enzymatique et est donc susceptible, comme cela vient d’être évoqué, de diminuer l’efficacité des chimiothérapies. À l’inverse, on notera également que certaines chimiothérapies peuvent accroître la toxicité de la phénytoïne en augmentant ses taux plasmatiques (11). Par ailleurs, il a également été démontré que la phénytoïne altérait la biodisponibilité de la dexaméthasone, et imposait le recours à des doses de corticoïdes plusieurs fois supérieures à celles administrées chez des patients non traités par cet antiépileptique. Enfin, certains auteurs contre-indiquent la prescription de phénytoïne chez des patients traités par radiothérapie cérébrale du fait d’un risque accru de survenue de syndrome de Stevens Johnson ou d’érythème polymorphe (12).. Efficacité du traitement antiépileptique On dispose de peu de données sur l’efficacité des traitements antiépileptiques chez les patients porteurs de tumeurs cérébrales. W. Wick et coll. (13) ont trouvé que dans plus de 50 % des cas, la monothérapie de première intention (molécules d’ancienne génération) était efficace, alors que pour J. Hildebrand et coll. (5), la proportion de patients d’emblée bien contrôlés sous monothérapie était bien plus faible. Peu d’études se sont intéressées spécifiquement à l’efficacité des molécules dites de nouvelle génération dans les tumeurs cérébrales. Des études préliminaires portant sur de faibles effectifs montrent toutefois des résultats encourageants avec le lévétiracétam (14). Il a également été démontré que la mise en place de certaines chimiothérapies (Témodal®) pouvait avoir un effet positif sur la fréquence modification du traitement antiépileptique de fond. De la même façon, il a été démontré qu’une exérèse complète ou suboptimale de la tumeur cérébrale était un facteur prédictif de bon contrôle des crises, ce d’autant plus que l’épilepsie évoluait depuis peu de temps au moment de l’intervention neurochirurgicale (15). Cas particulier du valproate de sodium Il a été suggéré que la valproate de sodium pourrait posséder des propriétés antitumorales intrinsèques par un mécanisme d’inhibition de l’histone déacetylase provoquant une dédifférenciation cellulaire, un arrêt de croissance voire une apoptose cellules tumorales. R. Tang et coll. (16) ont également suggéré que le valproate pourrait avoir un effet antipharmacorésistance par suppression de la MRDR1 (protéine de multi-résistance impliquée tout à la fois dans la résistance à certaines chimiothérapies et à certains médicaments antiépileptiques). Tolérance du médicament antiépileptique On note globalement avec les molécules d’ancienne génération, surtout les médicaments inducteurs enzymatiques, un risque accru d’intolérance à type d’allergies cutanées et d’effets toxiques. Les effets secondaires des molécules de nouvelle génération ont été moins étudiés, même si certains travaux suggèrent un bénéfice potentiel de l’utilisation de ces molécules. Accompagnement psychologique Chez des patients déjà fragilisés par l’annonce du diagnostic de tumeur cérébrale, la survenue de crises d’épilepsie peut être vécue très douloureusement et être ressentie comme une « double peine ». Par ailleurs, les interdits accompagnant l’épilepsie (conduite automobile, limitation d’accès ou de poursuite de certaines professions) peuvent également être source pour le patient de rejet et de sensation d’ostracisme. La prise en charge médicamenteuse devra donc être associée à un accompagnement psychosocial : prise en charge psychologique, traitements antidépresseurs si besoin, et d’informations sur la législation du travail et du permis de conduire. La prise en charge médicamenteuse devra donc être associée à un accompagnement psychosocial. Conclusion Il paraît actuellement licite de recommander de ne pas mettre en route de traitement antiépileptique prophylactique chez les patients nouvellement diagnostiqués comme porteurs d’une tumeur cérébrale. Cette attitude peut être nuancée en cas de tumeur cérébrale connue pour son fort potentiel épileptogène. Si ces patients doivent être opérés, la décision d’instaurer un traitement prophylactique de courte durée peut se discuter, mais reste du seul ressort du prescripteur. Lorsque l’épilepsie est déclarée, il conviendra par contre de mettre en route précocement un traitement antiépileptique. On recommandera prioritairement d’éviter les médicaments antiépileptiques inducteurs enzymatiques et, en particulier, la phénytoïne. Le choix se portera préférentiellement sur des traitements de nouvelle génération non inducteurs ou à défaut, en l’absence de désir de procréation s’il s’agit d’une patiente, sur le valproate de sodium. Des études randomisées portant sur de larges effectifs sont requises pour définir l’indication des traitements prophylactiques antiépileptiques dans la période post-opératoire précoce, et la place des nouvelles molécules antiépileptiques à la fois à visée préventive et curative.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





