Publié le 24 jan 2012Lecture 44 min
Les gliomes : diagnostic, classification, pronostic et traitement
J. PALLUD, Service de neurochirurgie, Centre Hospitalier Sainte-Anne, Université Paris Descartes
Les gliomes cérébraux infiltrants de l’adulte constituent un enjeu de santé publique, car ils affectent une population active et mettent systématiquement en jeu les pronostics fonctionnel et vital qui restent sombres. Les avancées dans les domaines de l’imagerie, de la biologie moléculaire et de la thérapeutique ont cependant permis la mise en place d’une prise en charge thérapeutique « à la carte » en fonction des caractéristiques de la tumeur et de celles du patient au sein de centres experts organisés en réseau pour dispenser les meilleurs soins tout en favorisant la recherche. Après un état des lieux détaillé sur le diagnostic, la classification et le pronostic, Johan Pallud poursuivra sur le traitement et le suivi des gliomes.
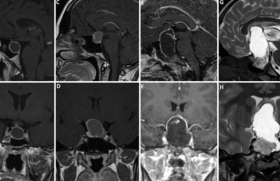
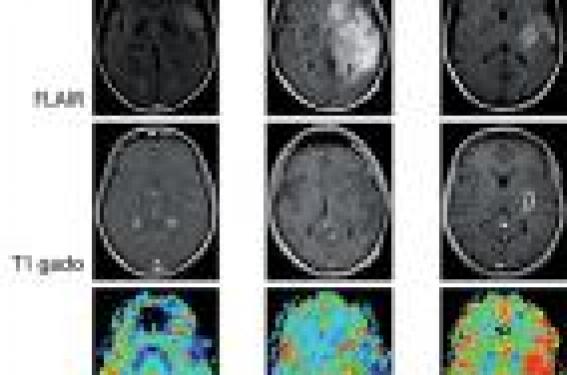
Diagnostic et classification Définition Les tumeurs primitives du système nerveux central regroupent un ensemble hétérogène de tumeurs. Les gliomes sont des tumeurs pr imi t ives du sys tème nerveux central développées aux dépens des cellules gliales et constituent les tumeurs neuro-épithéliales les plus f réquentes . Le présent chapitre sera délibérément dévolu aux gliomes infiltrants supra-tentoriels chez l’adulte (gliomes de grade II, III et IV selon la classification de l’OMS), excluant de facto les gliomes circonscrits de grade I et les gliomes du tronc cérébral. La problématique de la gliomatose cérébrale ne sera pas abordée ici. Nous chercherons donc à dresser un état des lieux synthétique et parfois simplifié des aspects pratiques de la prise en charge actuel le des gliomes infiltrants. Épidémiologie Les facteurs de risque des gliomes Concernant les facteurs intrinsèques, il existe une répartition différente des tumeurs cérébrales selon les ethnies, le sexe et l’âge, le risque de développer un gliome étant supérieur chez les Caucasiens, chez l’homme (rapport de 1,5 à 1,8 pour 1 femme) et s’accroissant avec l’âge. L’étude de polymorphismes génétiques met en évidence de nombreuses anomalies qui constituent des facteurs de risque de survenue d’un gliome. Les syndromes de prédisposition génétiques ne rendent comptent que de 1 % des gliomes (neurofibromatose de type 1 ou maladie de Von Recklinghausen, neurofibro-matose de type 2, syndrome de Fi-Fraumeni). Il est observé une augmentation du risque de survenue de gliome en cas d’antécédent de tumeur cérébrale ou de cancer connu chez les parents. Le poids élevé à la naissance (supérieur à 4 kilogrammes) augmente le risque de survenue d’un gliome. À l’inverse, il est observé une réduction du risque de survenue d’un gliome malin chez les sujets ayant un terrain atopique. Concernant les facteurs extrinsèques, l’implication des nitrates est discutée, la consommation de café, d’aspartame ou d’alcool ne semble pas impliquée dans le risque de survenue des gliomes. Le tabac semble augmenter le risque de gliome chez la femme si la consommation est supérieure à 2 paquets par jour. Aucun lien n’a été identifié avec les polyomavirus, mais il existe une relation inverse entre la survenue d’un gliome et une infection liée aux herpès virus. Devant le r isque accru de tumeur cérébrale chez les enfants nés en automne ou en hiver, l’hypothèse d’une infection survenue durant la grossesse ou après l’accouchement est avancée. L’étude de la latéralité montre que les gauchers et les ambidextres ont un risque réduit de gliome. Une diminution du risque est reconnue en cas de prise régulière et prolongée d’AINS. L’exposition aux antiépileptiques, neuroleptiques, diurétiques et antalgiques durant la grossesse ne semble pas associée à une augmentation du risque. L’âge tardif des premières règles (> 14 ans) et la ménopause précoce (< 45 ans) semblent accroître le risque. On retiendra l’impact négatif de la grossesse sur les gliomes diffus de bas grade, tel qu’on l’observe en pratique clinique (50 % d’aggravation clinique, 75 % d’accélération de la croissance radiologique, 25 % de nécessité de nouveau traitement). Concernant les facteurs professionnels, l’exposition au plomb et celle aux pesticides majore le risque de survenue d’un gliome. Celui-ci est également accru à l’âge adulte après des irradiations encéphaliques à visée thérapeutique effectuées dans l’enfance. On retiendra l’impact négatif de la grossesse sur les gliomes diffus de bas grade. Concernant les champs électromagnétiques, l’omniprésence, la multiplicité et la variabilité des sources d’exposition dans notre société, notamment celles liées à l’emploi des téléphones mobiles (type d’émetteur, distance à l’émetteur, port à l’oreille, emploi d’une oreillette, etc.) rendent extrêmement difficile la quantification de l’exposition. De nombreuses études ont été réalisées avec des résultats souvent contradictoires. Cependant, le Centre international de recherche sur le cancer (CIRC) de l’OMS a classé en mai 2011 les champs électromagnétiques de radiofréquence dans la catégorie des cancérogènes possibles pour l’homme sur la base d’un risque accru de gliome associé à l’usage du téléphone mobile. Le groupe de travail n’a pas quantifié le risque et a considéré les preuves évaluées comme étant limitées. Ainsi, le principe de précaution doit s’appliquer et de nouvelles études sont en cours. Les gliomes en France Il n’existe pas de registre centralisé dédié aux tumeurs primitives du système nerveux central en France. Leur incidence est estimée à 17,8 pour 100 000 habitants par an avec un taux d’incidence de 7,8/100 000 pour les tumeurs neuro-épithéliales. On note d’importantes variations géographiques aux niveaux continental, national et même régional, qui viennent étayer les hypothèses incriminant des facteurs environnementaux. En pratique, on peut grossièrement estimer que 3 000 nouveaux cas de glioblastomes (grade IV-OMS), 800 à 1 000 de gliomes anaplasiques (grade IIIOMS) et 500 à 700 de gliomes diffus de bas grade (grade IIOMS) surviennent annuellement en France. Vers une augmentation de l’incidence ? L’incidence des tumeurs cérébrales a augmenté de 0,5 à 1,5 % entre les années 1970 et 2000. En parallèle, on assiste en France à un doublement du taux de mortalité par tumeurs cérébrales. Pour expliquer l’augmentation des gliomes, on peut invoquer : • le vieillissement de la population, la fréquence des gliomes augmentant avec l’âge ; • l’amélioration de l’accès aux soins et l’amélioration des techniques d’imagerie ; • l’affinement des procédures neurochirurgicales autorisant aujourd’hui un très fort taux de confirmation histologique ; • et l ’appari t ion ou la progression de facteurs de risque aujourd’hui mal connus. L’incidence des tumeurs cérébrales a augmenté de 0,5 à 1,5 % entre les années 1970 et 2000. Diagnostic clinique et radiologique Les éléments du diagnostic clinique Les symptômes révélateurs d’un gliome ne sont pas spécifiques. La présence de la tumeur peut être révélée par une crise d’épilepsie inaugurale (souvent partielle), un déficit neurologique focalisé, un syndrome d’hypertension intracrânienne, des troubles neuropsychologiques. Enfin, un gliome peut être découvert de façon fortuite lors de la réalisation d’une imagerie cérébrale pour une autre indication. Classiquement, les gliomes diffus de bas grade sont diagnostiqués chez des adultes jeunes (âge moyen < 40 ans) ayant une vie familiale et socioprofessionnelle normale. Le gliome est alors révélé par une crise d’épilepsie inaugurale dans plus de 90 % des cas. L’examen neurologique est normal, mais des troubles neuropsychologiques sont constatés quasi systématiquement et se répercutent sur la qualité de vie des patients. À l’inverse, les glio blastomes sont diagnostiqués chez des patients plus âgés (âge moyen ± 55 ans). La lésion se révèle habituellement par un déficit neurologique rapidement progressif sur quelques semaines de façon concomitante à l’installation d’une hypertension intracrânienne. Ainsi, si les signes cliniques sont évocateurs d’une tumeur cérébrale, aucun ne permet d’affirmer le diagnostic de gliome ni d’en apprécier le grade de malignité. L’imagerie morphologique des gliomes Les gliomes se rencontrent essentiellement dans les hémisphères cérébraux, puis dans le tronc cérébral et, de façon exceptionnelle, dans le cervelet et la moelle épinière. Il n’existe pas de prédominance de côté. Les gliomes se répartissent proportionnellement aux volumes respectifs des différents lobes cérébraux, avec une prédominance frontale puis temporale. Ces tumeurs infiltrantes envahissent le cerveau et disséminent préférentiellement le long des fibres de substance blanche intralobaires, interlobaires, interhémisphériques et celles des voies longues. La prise de contraste après injection de gadolinium en séquence T1 est un argument en faveur d’une lésion agressive. L’imagerie permet d’envisager le diagnostic avec une haute probabilité, la certitude diagnostique restant, à l’heure actuelle, histologique. L’imagerie repose essentiellement, sauf contreindication, sur l’IRM. La tomodensitométrie cérébrale, qui peut montrer une image d’hypodensité spontanée, rehaussée ou non après injection de produit de contraste, reste utile pour mettre en évidence d’éventuelles calcifications. L’IRM morphologique met en évidence une image en hypo- ou isosignal en séquence T1, généralement homogène, ainsi qu’un hypersignal en séquence T2 et FLAIR. Une hétérogénéité de signal peut s’observer au sein de la tumeur en cas d’hémorragies, de calcifications ou de kystes. La prise de contraste après injection de gadolinium en séquence T1 est un argument en faveur d’une lésion agressive est constitué un signe radiologique habituel de malignité. Cependant, des prises de contraste peu intenses et mal définies s’observent parfois dans les gliomes diffus de bas grade et une prise de contraste peut exceptionnellement être absente au sein d’un authentique gliome malin. Enfin, il est à noter que l’IRM, quelle que soit la modalité utilisée, sous-estime l’extension spatiale réelle des gliomes de tous grades, et qu’il existe des cellules tumorales isolées audelà de toute anomalie visible à l’IRM. Vers un bilan d’imagerie IRM multimodale ? Aujourd’hui, l’imagerie des gliomes dépasse la simple approche morphologique. Ses objectifs sont multiples : - envisager le diagnostic positif et éliminer les diagnostics différentiels ; - renseigner le pronostic ; - et guider la prise en charge neurochirurgicale (repérages anatomique et fonctionnel, délimitation spatiale de la tumeur, ciblages des zones tumorales les plus agressives). Elle doit donc être réalisée dans un centre rompu à l’étude des tumeurs cérébrales. La confrontation de l’imagerie morphologique (T1, T2, FLAIR, gadolinium) à des séquences d’imagerie visant à refléter le métabolisme tissulaire cérébral (diffusion, perfusion, spectroscopie) constitue l’approche IRM multimodale. L’IRM de diffusion apprécie la densité cellulaire en mesurant le coefficient apparent de diffusion (diffusion restreinte en cas de densité augmentée). L’IRM de perfusion apprécie la vascularisation et la néoangiogenèse en mesurant le volume sanguin cérébral relatif (VSCr). La spectroscopie IRM du proton permet d’apprécier le métabolisme cellulaire. Différents marqueurs sont étudiés en routine : - la créatine reflète le statut énergétique cellulaire et constitue un pic de référence ; - la choline est un marqueur du turn-over membranaire et de la densité cellulaire ; - le N-acétylaspartate (NAA) est un marqueur de la viabilité neuronale ; - les lactates sont le témoin d’un métabolisme anaérobie ; - les lipides signent la présence d’une nécrose ; - et le myo-inositol est un marqueur de la glie et de la prolifération gliale. Concernant la perfusion, il n’existe classiquement pas d’anomalie significative du VSCr dans les gliomes diffus de bas grade (les oligodendrogliomes présentant un VSCr supérieur à celui des astrocytomes) et l’élévation du VSCr est un indicateur d’une transformation maligne qui précède l’apparition de la prise de contraste en séquence T1 après injection de gadolinium. Concernant la spectroscopie, un gliome diffus de bas grade présente une élévation du myo-inositol, de la choline mais une baisse du NAA responsables d’une augmentation modérée du rapport choline/NAA. La transformation maligne engendre des modifications spectroscopiques qui précèdent les modifications de la perfusion et l’apparition de la prise de contraste. On observe alors une chute du myo-inositol, une majoration de l’élévation de la choline et une poursuite de la baisse du NAA responsables d’une augmentation importante du rapport choline/NAA. Il apparaît ensuite des lactates qui précèdent l’installation d’une néoangiongenèse puis des lipides, signant la nécrose (figure 1). Figure 1. Caractéristiques radiologiques des gliomes. Le gliome diffus de bas grade (grade II selon l’OMS – colonne de gauche) se caractérise par un hypo- ou isosignal T1, un hypersignal T2 et FLAIR, une absence de prise de contraste, une absence d’hyperperfusion significative et un profil spectroscopique associant une élévation du myo-inositol, une élévation de la choline et une baisse du NAA responsables d’une augmentation modérée du rapport choline/NAA. Le gliome anaplasique (grade III selon l’OMS – colonne centrale) se caractérise par un hypoou isosignal T1, un hypersignal T2 et FLAIR, une prise de contraste variable souvent nodulaire et multifocale associée à des plages d’hyperperfusion. Le glioblastome (grade IV selon l’OMS – colonne de droite) se caractérise par un hyposignal T1, un hypersignal T2 et FLAIR, une prise de contraste souvent annulaire avec un hyposignal central, parfois nodulaire et multifocale, associée à une franche hyperperfusion et un profil spectroscopique associant une chute du myo-inositol, une élévation importante de la choline, une chute du NAA responsables d’une augmentation importante du rapport choline/NAA, ainsi qu’une apparition de lactates et de lipides. L’IRM multimodale pour le diagnostic différentiel des gliomes Certaines lésions intracérébrales peuvent soulever la question du diagnostic différentiel entre gliome, métastase d’un cancer solide, abcès à pyogènes ou lymphome cérébral primitif. L’approche multimodale s’avère alors utile. Concernant l’abcès, sa nécrose centrale riche en débris cellulaires se traduit par une diminution caractéristique du coefficient apparent de diffusion et son profil spectroscopique présente une élévation des lactates, une présence possible d’acides aminés et une absence d’augmentation de la choline. La métastase, qui ne présente pas d’infiltration tumorale dans sa périphérie, peut donc se différencier d’un gliome par l’absence d’anomalie spectroscopique au sein de l’oedème vasogénique l’entourant. Le lymphome cérébral primitif se caractérise par une diminution du coefficient apparent de diffusion en rapport avec sa cellularité élevée, par un profil spectroscopique particulier et par une faible hyperperfusion. La tomographie par émission de positons pour le diagnostic des gliomes La TEP donne des informations quantitatives et localisées sur l’état métabolique des gliomes. La TEP au 18F-fluorodéoxyglucose (FDG) est d’usage limité dans les gliomes par un faible différentiel de captation entre tissu tumoral et tissu sain. Elle est cependant utile pour mettre en évidence une transformation maligne au sein d’un gliome de bas grade, visualisée par une élévation focale de la captation de FDG et pour différencier une reprise évolutive tumorale après radiothérapie d’une modification post-thérapeutique, visualisée par une absence d’augmentation de la captation de FDG au sein de la prise de contraste à l’IRM. La TEP à la 11C-méthionine (MET) est plus fréquemment utilisée pour le bilan des gliomes. La TEP à la 11C-méthionine (MET) est plus fréquemment utilisée pour le bilan des gliomes car le meilleur différentiel de captation entre tissu tumoral et tissu sain couplé à la bonne corrélation entre captation et activité tumorale permettent de les délimiter correctement. Ainsi, par rapport au FDG, la MET permet de mieux différencier les gliomes de lésions non tumorales, de guider les biopsies stéréotaxiques dans les zones tumorales les plus actives, de délimiter le volume tumoral et de suivre l’effet des traitements oncologiques. Enfin, la 18F-fluoro-L-thymidine (FLT) et la 18F-fluoroéthyltyrosine (FET) sont des marqueurs plus récents qui semblent apporter une sensibilité accrue pour suivre l’effet des traitements oncologiques par radiothérapie et chimiothérapie. Ils permettraient une détection précoce des patients répondeurs ou non au traitement appliqué. Diagnostic histologique La classification internationale de l’OMS La classification internationale des tumeurs du système nerveux central est celle de l’Organisation Mondiale de la santé (OMS), dont la dernière révision a été effectuée en 2007. Elle repose uniquement sur l’analyse de critères histologiques (type et grade) sans tenir compte des données cliniques ni de l’imagerie. La définition du type histologique dépend du type cellulaire prédominant : si une tumeur apparaît en majorité composée d’astrocytes ou d’oligodendrocytes, elle sera classée en astrocytome ou en oligodendrogliome, et si elle comporte une « substantielle proportion » d’astrocytes et d’oligodendrocytes, elle sera classée en oligoastrocytome (ou gliome mixte). Une fois le type histologique défini, le grade de malignité est établi de façon croissante en fonction : du type histologique, du degré de différentiation ou « anaplasie » et de critères histologiques non spéci f iques (densité cellulaire, activité mitot ique, atypies nucléai res , nécrose, prolifération microvasculaire). Il existe ainsi quatre grades de histopronostiques de gravité croissante (grade I à IV). On oppose les gliomes circonscrits (grade I), toujours bénins, aux gliomes diffus (ou infiltrants) de bas grade (grade II) ou malins (grade III et IV). Par exemple, l’astrocytome diffus (grade II) est défini par une cellularité augmentée, des atypies nucélaires et, au maximum, une mitose. L’astrocytome anaplasique (grade III) se caractérise par une densité cellulaire nettement plus importante, des atypies nucléaires marquées et des mitoses. La présence d’une nécrose et d’une prolifération microvasculaire, en addition à ces précédentes altérations, caractérisent le glioblastome (grade IV). Il existe un continuum entre gliome de bas grade de malignité et gliome malin (figure 2). Figure 2. Le continuum évolutif des gliomes. Un gliome diffus de bas grade frontal gauche est découvert sur une crise d’épilepsie inaugurale et une exérèse subtotale est réalisée (oligodendrogliome de grade A selon Sainte-Anne – grade II selon l’OMS). Le suivi régulier montre une croissance continue et linéaire du diamètre moyen du reliquat tumoral chez un patient asymptomatique. Après 4 ans de suivi, le patient présente une recrudescence des crises épileptiques, sans modification de la vitesse de croissance radiologique. Une radiothérapie conformationnelle (50,4 Gy) est alors réalisée. Elle permet une stabilisation de la croissance tumorale et un contrôle des crises d’épilepsie. Après 7 ans de suivi, on observe une reprise de la croissance radiologique. Après 8 ans de suivi, on observe une recrudescence des crises épileptiques. Une nouvelle exérèse subtotale est réalisée en condition éveillée (oligodendrogliome de grade B selon Sainte-Anne – grade II selon l’OMS). Une très nette accélération de la croissance tumorale, précédant l’apparition de plages de prise de contraste, sont observées en postopératoires et signent la transformation maligne. Un traitement adjuvant par radiothérapie et chimiothérapie concomitante puis chimiothérapie adjuvante par témozolomide (schéma type Stupp) est débuté. Les gliomes de grade II se transforment systématiquement en gliomes malins. Ainsi, ils ne doivent pas être considérés comme des tumeurs bénignes mais bien comme des tumeurs précancéreuses. Cependant, la majorité des gliomes malins apparaissent de novo et sont parfois issus de la transformation d’un gliome de bas grade. Il existe un continuum entre gliome de bas grade de malignité et gliome malin. La classification alternative de l’hôpital Sainte-Anne La classification des formes communes de gliomes de l’hôpital Sainte-Anne correspond à une démarche diagnostique originale intégrant les données cliniques, radiologiques et histologiques. Elle définit ainsi quatre classes de gliomes : les oligodendrogliomes de grade A, les oligodendrogliomes de grade B, les glioblastomes et les tumeur glioneuronales malignes. Elle ne reconnaît pas l’existence des astrocytomes. Dans cette approche, l’apparition d’une microangiogenèse, liée au développement d’une composante tumorale solide, est un événement crucial dans la progression des oligodendrogliomes qui se traduit radiologiquement par l’apparition d’une prise de contraste. La microangiogenèse, élément central du système de grades des oligodendrogliomes, est appréciée à partir de deux critères complémentaires : la présence d’une hyperplasie des cellules endothéliales à l’étude histologique et la prise de contraste à l’étude radiologique. Il existe ainsi deux grades de malignité : grade A avec absence d’hyperplasie endothéliale et de prise de contraste, et grade B avec la présence d’une hyperplasie endothéliale et/ou d’une prise de contraste. Les faiblesses des classifications histologiques L’existence de deux classifications, l’une officielle établie par l’OMS, l’autre alternative, souligne les limites de la première basée uniquement sur des critères histologiques. Il n’y a pas de parallélisme entre ces deux principales classifications qui sont fondées sur une approche conceptuelle radicalement différente. L’arrivée récente de la classification de l’hôpital Sainte-Anne a modifié les habitudes des utilisateurs de la classification de l’OMS et l’on observe de grandes variations du typage histologique des gliomes au cours du temps. La limitation commune à ces classifications est la division en différents grades de malignité qui ne reflètent pas le continuum évolutif. Ces variations rendent difficile les comparaisons entre séries et l’interprétation des données de la littérature. La limitation commune à ces classifications est l’inévitable division dichotomique en différents grades de malignité qui ne reflètent pas le continuum évolutif observé dans les gliomes. Ainsi, certaines tumeurs sont difficiles à classer en pratique, étant intermédiaires entre grade II et grade III selon l’OMS et entre grade A et grade B selon l’hôpital Sainte-Anne. La classification de gliomes en grade « II + » ou en grade « A/B », que l’on observe parfois en pratique clinique, illustre donc l’existence d’un « no man’s land » dans les classifications et fait discuter la place d’un grade intermédiaire entre bas et haut grades de malignité. Une des faiblesses de la classification de l’OMS réside dans l’absence de prise en compte de l’hétérogénéité des gliomes infiltrants, au sein desquels peuvent coexister des plages tumorales de différents grades de malignité, ainsi que des cellules non tumorales. En effet, l’ensemble de la population cellulaire observée est considéré comme étant tumorale et il n’y pas de distinction avec les cellules appartenant au parenchyme infiltré. Il est donc parfois difficile d’établir le juste grade histologique d’un gliome, d’autant plus si les prélèvements analysés sont de taille limitée et/ou s’ils portent sur les zones les moins actives. La classification de l’OMS ne pallie donc pas le possible manque de représentativité des prélèvements, et un même gliome est susceptible d’être classé en différents grades de malignité, selon le prélèvement étudié. Il existe ici un risque de sous-estimation du grade de malignité. L’autre principale faiblesse est son manque de reproductibilité (reproductiblités inter-observateur et intraobservateur ± 50 %), car les critères employés pour définir le grade histologique sont non spécifiques, imprécis et laissent une large place à la subjectivité individuelle des pathologistes. Le principal apport de la classification de l’hôpital Sainte-Anne est l’intégration des données de l’imagerie qui est ici considérée comme l’examen macroscopique de la tumeur, permettant donc de s’affranchir des problèmes de représentativité du prélèvement histologique. Cette notion simple permet d’éviter une sous-estimation du grade de malignité. D’autre part, cette classification permet d’augmenter la reproductibilité du grade histologique grâce à l’emploi d’un nombre restreint de critères, dont la caractérisation entre absence et présence laisse peu de place, en théorie, à la subjectivité individuelle. Il semble indispensable que les marqueurs moléculaires spécifiques nouvellement identifiés et les données de l’imagerie soient intégrés aux données hi s topathologiques pour élaborer une prochaine classification reflétant mieux le continuum évolutif des gliomes. Diagnostic moléculaire Une meilleure compréhension des altérations moléculaires observées dans les gliomes est donc nécessaire pour renforcer la valeur prédictive et pronostique des classifications. À ce jour, trois marqueurs moléculaires sont reconnus d’intérêt pronostique pour les gliomes. En pratique, il convient de recueillir le consentement écrit du patient, puis de prélever un simple tube de sang en parallèle au prélèvement tumoral. Les principales altérations moléculaires • La perte totale et combinée (co-délétion) d’une copie du bras court du chromosome 1 (1p) et du bras long du chromosome 19 (19q) est observée principalement dans les oligodendrogliomes et les gliomes mixtes. Sa présence est un facteur pronostique fort mais également un facteur prédictif de la réponse à la chimiothérapie et à la radiothérapie, quel que soit le grade de malignité. Il est à noter que la perte isolée et partielle en 1p est associée à un mauvais pronostic. La co-délétion 1p19q est un facteur pronostique fort. • L’O6-méthylguanine-DNA méthyltransférase (MGMT) est une enzyme de réparation de l’ADN dont l’action semble réduire l’efficacité des chimiothérapies par agents alkylants. L’inactivation du gène de MGMT, par méthylation de son promoteur, réduit la réparation des lésions chimioinduites. La méthylation de ce gène est donc considérée comme un facteur prédictif de meilleure réponse à la chimiothérapie, ainsi qu’à la radiothérapie et constitue également un facteur de bon pronostic dans les glioblastomes. Il reste cependant à déterminer la meilleure technique à utiliser pour mettre en évidence cette anomalie. La présence d’une mutation de l’IDH est un facteur de bon pronostic, quel que soit le grade du gliome. • L’isocitrate déshydrogénase (IDH) est une enzyme impliquée dans les processus de protection contre le stress oxydatif (IDH1 dans le cytoplasme, IDH2 isoforme mitochondrial). Les mécanismes par lesquels les mutations des gènes de l’IDH favorisent le développement des gliomes sont mal compris. La présence de la mutation IDH constitue une aide diagnostique précieuse car elle est inversement corrélée au grade des gliomes : elle est présente dans plus de 75 % des grades II, près de 50 % des grades III et dans 10 % des grades IV. Dans le cadre des gliomes de grade IV, elle est présente dans 80 % des glioblastomes secondaires et dans moins de 5 % des glioblastomes primaires. De plus, la présence d’une mutation de l’IDH est un facteur de bon pronostic, quel que soit le grade du gliome. Il existe une cohérence dans l’expression des altérations moléculaires dans les gliomes. La présence de la perte combinée 1p19q est mutuellement exclusive de la mutation de p53. À l’inverse, elle est fréquemment associée à la méthylation du gène promoteur de MGMT et aux mutations IDH. Vers une classification histomoléculaire ? Les marqueurs moléculaires constituent donc de nouveaux outils qui viennent seconder la classification histopathologique des gliomes de l’OMS. Il est hautement probable que la prochaine révision de la classification des gliomes tienne compte de ces données récentes et propose de nouveaux groupes tumoraux en fonction du statut moléculaire. De plus, les travaux en cours sur le profil d’expression génique au sein des gliomes tendent à faire apparaître des groupes particuliers qui viendront bientôt aider le démembrement des gliomes infiltrants. Pronostic Le sombre pronostic des gliomes Le développement récent des options thérapeutiques (chimiothérapies systémique et in situ) et les améliorations techniques (chirurgie, radiothérapie) combinés aux avancées considérables de la recherche fondamentale et clinique en neuro-oncologie a permis d’augmenter de façon substantielle la durée de vie, mais surtout la qualité de vie, des patients atteints d’un gliome infiltrant. Malgré ces avancées, le pronostic des gliomes reste sombre, sans curabilité possible. Ainsi, la survie moyenne est de 12 à 18 mois pour les glioblastomes (grade IV) avec moins de 10 % de survivants à 5 ans. Les gliomes diffus de bas grade (grade II) ont une survie moyenne s’étalant entre 8 et 12 ans avec 40 à 60 % de survivants à 5 ans. Les gliomes anaplasiques (grade I I I ) ont une survie moyenne d’étalant de 2 à 7 ans, proche des glioblastomes pour les tumeurs sans co-délétion 1p19q, et à l’inverse, une survie équivalente à celle des gliomes de bas grade pour les tumeurs présentant la co-délétion. Les gliomes diffus de bas grade (grade II) ont une survie moyenne s’étalant entre 8 et 12 ans avec 40 à 60 % de survivants à 5 ans. Les principaux facteurs pronostiques De nombreux facteur s , cliniques, morphologiques, histologiques, moléculaires, thérapeutiques sont reconnus comme ayant une valeur pronostique dans les gliomes infiltrants. • Pour les gliomes de bas grade (grade II), l’âge, la présence d’un déficit neurologique, la taille de la tumeur, le franchissement de la ligne médiane et le diagnostic histologique d’astrocytome sont corrélés de façon indépendante à la survie. La présence d’une prise de contraste nodulaire ou se modifiant sur des images successives, fortement évocatrice d’une transformation maligne, constitue un facteur de mauvais pronostic. Parmi les facteurs moléculaires, la co-délétion 1p19q, les mutations de l’IDH et la méthylation du promoteur MGMT sont des facteurs de bon pronostic. Enfin, un facteur morphologique dynamique, déterminé lors du suivi longitudinal du gliome dans le temps, a récemment été mis en évidence. Il apparaît que le taux de croissance tumorale spontané, apprécié aisément par la mesure du diamètre tumoral moyen sur des IRMs successives avant tout traitement, constitue un facteur pronostique individuel indépendant. • Pour les gliomes anaplasiques (grade III), l’âge, l’index de performance, la localisation tumorale, le volume tumoral, l’extension de la résection chirurgicale sont des facteurs pronostiques corrélés de façon indépendante à la survie. Parmi les facteurs histologiques, la présence d’une prolifération endothéliale et d’une nécrose, apparaissent comme des facteurs de mauvais pronostic. Parmi les facteurs moléculaires, la présence d’une co-délétion 1p19q et/ou d’une mutation de l’IDH sont des facteurs de meilleur pronostic, alors que la présence d’une amplification génique a une influence péjorative. • Pour les glioblastomes (grade IV), l’âge est corrélé de manière linéaire au pronostic qui est de plus en plus péjoratif avec l’avancée de l’âge. L’existence d’un déficit neurologique, le volume tumoral, la localisation tumorale et les modalités thérapeutiques sont corrélés de façon indépendante à la survie. Parmi les facteurs moléculaires, les mutations de l’IDH et la méthylation du promoteur MGMT sont des facteurs de bon pronostic. La présence des mutations de l’IDH permet d’identifier un sous-groupe de glioblastomes secondaires de meilleur pronostic. Ces différents facteurs pronostiques ont plus de poids lorsqu’ils sont associés. La méthode d’analyse récursive par répartition permet d’identifier les facteurs les plus pertinents pour réunir les patients en sousgroupes dont les survies respectives sont différentes. Ce regroupement permet, en pratique clinique, d’estimer grossièrement l’espérance de vie d’un patient et d’adapter la prise en charge thérapeutique. Traitement Prise en charge thérapeutique Aujourd’hui, la prise en charge thérapeutique des gliomes, quel que soit leur grade, doit être discutée en réu - nion de concertation pluridisciplinaire (RCP). Le neurochirurgien est au centre des décisions car le geste chirurgical (exérèse ou biopsie) constitue la première étape de la prise en charge oncologique d’un gliome. La RCP permet, en théorie, de proposer le meilleur traitement oncologique, adapté à chaque cas, et de favoriser l’accès à des essais cliniques. Elle per - met également de s’assurer que le bi - lan préthérapeutique est complet (imagerie morphologique et multimodale, suivi IRM longitudinal en cas de gliome diffus de bas grade, bilan neuropsychologique, prélèvements sanguins, consentements écrits d’autorisation d’utilisation des données à des fins de recherche et de non-refus à l’analyse des caractéristiques génétiques tumorales). Les armes thérapeutiques Les moyens thérapeutiques à disposition sont ceux disponibles face à toute tumeur : chirurgie, radiothérapie, chimiothérapie systémique et chimiothérapie in situ. Figure 3. Couplage entre anomalies de l’imagerie et analyse anatomo-pathologique. Exemple d’une biopsie stéréotaxique étagée réalisée avec un robot chirurgical pour le diagnostic d’un glioblastome bi-fronto-calleux. L’échantillonnage des différentes composantes de l’imagerie permet d’objectiver une infiltration du parenchyme cérébral par des cellules tumorales isolées (A), une composante de tissu tumoral solide avec néoangiogenèse (B) et de la nécrose (C). Le contrôle tumoral local par une combinaison entre chirurgie, radiothérapie et chimiothérapie est la pierre angulaire du traitement oncologique des gliomes. Il existe deux types d’interventions neurochirurgicales : • la biopsie à visée diagnostique (avec, idéalement, un examen anatomo-pathologique extemporané) réalisée en condition stéréotaxique ou à ciel ouvert sous guidage neuronavigationnel ; • l’exérèse chirurgicale sous guidages peropératoires anatomique (neuronavigation, échographie peropératoire, IRM peropératoire) et fonctionnel (repérage des aires cérébrales fonctionnelles par stimulations électriques corticales et sous-corticales). Les prélèvements biopsiques doivent couvrir l’ensemble des composantes du gliome visibles à l’IRM pour pallier un biais de représentativité lié à l’hétérogénéité tumorale (figure 3). Les prélèvements doivent également comprendre suffisamment de matériel pour permettre les analyses anatomopathologique et moléculaire. Outre l’obtention d’un diagnostic histologique de certitude, l’exérèse chirurgicale offre l’avantage du traitement symptomatique par la levée de l’effet de masse et du traitement oncologique en réséquant le processus pathologique. En effet, s’il n’existe pas d’étude prospective randomisée démontrant l’impact positif de la résection chirurgicale d’un gliome en terme de délai sans progression ou de survie globale, les différentes études disponibles montrent un avantage net chez les patients opérés, et suggèrent que la résection la plus complète possible est un facteur de meilleur pronostic, quel que soit le grade du gliome. Il convient cependant de quantifier la qualité de l’exérèse chirurgicale sur l’IRM postopératoire, réalisée précocement (dans les 48 heures postopératoires) en cas de gliome malin (grade III, IV) ou à partir du troisième mois postopératoire en cas de gliome de grade II. L’exérèse chirurgicale offre l’avantage du traitement symptomatique par la levée de l’effet de masse et du traitement oncologique en réséquant le processus pathologique. Radiothérapie La radiothérapie des gliomes a pu bénéficier de progrès techniques et de l’avancée de l’imagerie. Les nouvelles techniques d’irradiation non coplanaires et d’irradiation conformationnelle avec modulation d’intensité facilitent la protection des structures cérébrales à risque et du cerveau sain. Elles permettent ainsi une intensi f icat ion de dose dans les volumes cibles, quand cela est requis. Les progrès de l’imagerie, avec l’intégration de l’IRM multimodale dans le planning de traitement, aident à une meilleure définition des volumes cibles et des zones à risque élevé de reprise évolutive. Le volume, la dose et le fractionnement de la radiothérapie dépendent du grade du gliome. Le volume cible est déterminé sur les données de l’IRM : • le volume tumoral macroscopique (GTV) est défini par la plage de prise de contraste en séquence T1 pour les glioblastomes (grade IV) par la plage d’hypersignal T2 ou FLAIR pour les gliomes de grade II et III ; • le volume cible anatomoclinique (CTV) tient compte de la présence de cellules tumorales dans les zones adjacentes à la tumeur, de leur dissémination préférentielle le long des fibres de substance blanche et des barrières anatomiques ; • le volume cible prévisionnel (PTV) dépend de la précision géométrique des équipements de contention. Le volume, la dose et le fractionnement de la radiothérapie dépendent du grade du gliome. Chimiothérapie De très nombreuses chimiothérapies systémiques ont été proposées pour le traitement des gliomes. Deux régimes récents de chimiothérapie sont à souligner du fait des espoirs soulevés concernant l’amélioration de la prise en charge oncologique des gliomes malins : le témozolomide et le bévacizumab. Le témozolomide est un agent alkylant cytotoxique oral qui s’est imposé en traitement de première ligne des gliomes malins en association avec la radiothérapie et en traitement de rattrapage, du fait de son efficacité et de sa tolérance. Il est également en cours d’évaluation en tant que traitement néo-adjuvant avant chirurgie ou en tant que traitement de première ligne dans les gliomes diffus de bas grade. Le bévacizumab est un anticorps recombinant monoclonal humanisé inactivant le VEGF. Il est utilisé en tant qu’angiogénique, seul ou en association avec l’irinotécan (inhibiteur de la topoisomérase de type 1), et constitue la première thérapie ciblée largement utilisée pour le traitement des gliomes malins. Le bévacizumab constitue un traitement utile à la récidive des gliomes malins. Son utilisation est cependant rendue délicate par sa toxicité significative (cicatricielle, digestive, thrombo-embolique, cardiovasculaire, rénale) et son utilité en traitement de première ligne reste à démontrer. Une chimiothérapie systémique, quelle qu’elle soit, doit être encadrée. Il convient à chaque cure d’évaluer la toxicité clinique et biologique, de s’assurer de l’absence de contre-indications clinique ou biologique, de calculer la dose à administrer, d’en surveiller la tolérance et de prescrire les mesures adjuvantes. Le traitement des gliomes diffus de bas grade (grade II) Il n’y a pas de prise en charge thérapeutique standardisée concernant les gliomes de grade II. L’attitude actuelle des centres spécialisés consiste en une prise en charge active avec exérèse chirurgicale sans attendre la transformation maligne. Des recommandations de prise en charge ont été émises en 2010 à l’échelon européen, sous l’égide de la Fédération européenne des Sociétés neurologiques et de l’Association européenne de neuro-oncologie. Il est admis que l’exérèse chirurgicale constitue la première option thérapeutique, dans l’optique de réaliser une exérèse maximale respectueuse de la fonction. L’emploi des techniques pré- et peropératoires d’identification des aires cérébrales fonctionnelles est requis (figure 4). Figure 4.Repérage fonctionnel cortical et sous-cortical pré- et peropératoire. Exemple d’un gliome diffus de bas grade pariétal gauche. L’IRM fonctionnelle pré-opératoire montre des activations fonctionnelles corticales lors des épreuves du langage (haut à gauche) et de sensibilité (haut à droite). L’IRM en tenseur de diffusion avec tractographie montre la proximité du faisceau fronto-occipital inférieur et des voies visuelles avec la partie profonde du gliome (centre droit et gauche). Repérage fonctionnel peropératoire avec réveil du patient avant la résection (bas à gauche) et après la résection (bas à droite) ayant permis la réalisation d’une exérèse la plus complète possible respectant les aires corticales et sous-corticales cruciales pour la fonction. Dans le cas présent, la résection a été limitée en profondeur par la présence de réponses à la stimulation sous-corticale à type de troubles sémantiques et phonémiques (44-47) correspondant au passage des faisceaux fronto-occipital inférieur et longitudinal supérieur et à type de troubles moteurs (4,5) correspondant au passage du faisceau pyramidal. À défaut, une confirmation diagnostique par biopsie est proposée. En cas de facteurs pronostiques défavorables, un traitement oncologique adjuvant est indiqué et consiste habituellement en une radiothérapie (dose totale de 50,4 Gy en fractions de 1,8 Gy). En l’absence de facteurs de mauvais pronostic, une surveillance régulière sans traitement adjuvant peut être proposée après la chirurgie. Enfin, la chimiothérapie est une option thérapeutique en cas de poursuite évolutive tumorale après chirurgie et/ou radiothérapie. Elle constitue également une option thérapeutique en alternative à la radiothérapie, afin d’éviter ses complications tardives, particulièrement si une codélétion 1p19q est présente. Un suivi clinico-radiologique au long cours est requis et doit comprendre une évaluation neuropsychologique. Le traitement des gliomes anaplasiques (grade III) Le traitement de première ligne comprend, si cela est possible, une chirurgie d’exérèse la plus complète possible. À défaut, une confirmation diagnostique par biopsie sera réalisée sur les zones radiologiques les plus péjoratives. Il n’existe pas de traitement standard reconnu pour la prise en charge oncologique postopératoire de première ligne et, ni la place, ni la chronologie de la radiothérapie et de la chimiothérapie ne sont clairement établies. Différentes options sont donc possibles : radiothérapie seule, chimiothérapie seule et association radiothérapie et chimiothérapie. La technique de radiothérapie est identique à celle des glioblastomes (60 Gy en 30 fractions de 2 Gy ; 59,4Gy en 33 fractions de 1,8 Gy). Le témozolomide est la chimiothérapie souvent proposée en première intention en raison de sa tolérance et de sa facilité d’administration (per os). En pratique, l’attitude actuelle tend à définir le traitement postopératoire en fonction du statut 1p19q. Si une co-délétion 1p19q est présente, synonyme de bon pronostic, une radiothérapie seule est proposée. En l’absence de co-délétion, le pronostic est défavorable et le traitement proposé est celui des glioblastomes. Il s’agit d’une association radiothérapie et chimiothérapie par témozolomide. Il n’existe pas de traitement standard reconnu pour la prise en charge oncologique postopératoire de première ligne. Le traitement des glioblastomes (grade IV) Le traitement de première ligne comprend, si cela est possible, une chirurgie d’exérèse la plus complète possible. Après la chirurgie, le traitement est codifié en fonction de l’âge et du statut clinique. Les patients en bon état clinique (OMS0, 1 ou 2) et âgés de moins de 70 ans bénéficient d’une association radiothérapie et chimiothérapie par témozolomide selon un schéma dit de Stupp, en référence au premier signataire de la publication princeps. Ce schéma consiste en une radiothérapie conformationnelle (60 Gy en 30 fractions de 2 Gy; 5 fractions par semaine) associée à une chimiothérapie concomitante par témozolomide oral (75 mg/m2/j). La radiothérapie doit être débutée dans les 6 semaines suivant la chirurgie. Suit un traitement par chimiothérapie adjuvante 1 mois après la fin de l’association radiothérapie-chimiothérapie par du témozolomide oral (150-200 mg/m2/j, 5 jours par mois) pour une durée minimale de 6 mois. Pour les patients âgés, il peut être proposé une radiothérapie seule à dose réduite ou le schéma de type Stupp, chez les personnes en bon état général avec une tumeur réséquée. Enfin, il n’a pas été démontré d’efficacité oncologique à réaliser un traitement pour les patients grabataires et une attitude palliative est alors proposée d’emblée. La chimiothérapie in situ constitue une option thérapeutique qui doit être discutée dans le traitement de première ligne des glioblastomes. En parallèle à ce standard de traitement, une chimiothérapie locale in situ consistant en la dépose peropératoire d’implants de carmustine au pourtour de la cavité opératoire est disponible. Cette chimiothérapie locale, qui pénètre sur plusieurs millimètres en bordure de résection, agit pendant quelques semaines. Elle vient donc pallier l’intervalle de traitement existant entre la chirurgie et le début de l’association radiothérapie et chimiothérapie. Un bénéfice sur la survie a été démontré dans les gliomes malins. Sa place par rapport au schéma de type Stupp n’a pas été prouvée, mais leur combinaison semble efficace et bien tolérée. La chimiothérapie in situconstitue donc une option thérapeutique qui doit être discutée dans le traitement de première ligne des glioblastomes. Le traitement des récidives La récidive (après disparition de toute anomalie IRM et contrôle clinique) ou la reprise évolutive (après stabilisation des anomalies IRM et contrôle clinique) surviennent systématiquement à distance du traitement oncologique de première ligne des gliomes infiltrants, quel que soit leur grade. Elles justifient donc la réalisation d’un suivi clinique et radiologique régulier chez tout patient porteur d’un gliome. Avant d’envisager un nouveau traitement, il convient au préalable d’éliminer une pseudo-progression radiologique (ou une modification post-thérapeutique pseudo tumorale). Il n’y a pas de standard de traitement à la récidive d’un gliome, quel que soit son grade. La prise en charge thérapeutique et l’inclusion dans des essais thérapeutiques doivent également être discutées en RCP. La possibilité d’une reprise chirurgicale doit être envisagée et réalisée chaque fois que cela est possible. Le traitement sera ensuite adapté en fonction du grade histologique et des traitements préalablement effectués. Il pourra comprendre une chimiothérapie peropératoire in situ, une chimiothérapie de 1re ou de 2e ligne, un traitement antiangiogénique et une ré-irradiation. Suivi des gliomes La récidive ou la reprise évolutive des gliomes étant systématique, quel que soit le grade de malignité, il est nécessaire de suivre à vie tout patient porteur d’un gliome infiltrant. Modalités et rythmes de suivi Le suivi clinico-radiologique est assuré en partenariat avec les différents acteurs de la prise en charge neuro-oncologique (neurochirurgien, radiothérapeute, neurologue et neuro-oncologue). L’ensemble du suivi IRM doit être disponible pour autoriser des comparaisons quantifiées entre les différents examens. Les IRM doivent êt re fai tes selon les mêmes modalités techniques et les images doivent être reproductibles (séquences, épaisseur et plan de coupe, temps d’acquisition après injection de gadolinium). Les consoles de post-traitement radiologique permettent aujourd’hui un traitement avancé des images et facilitent ainsi les comparaisons. Les séquences comportent au minimum une séquence T1 sans et avec injection de produit de contraste, et une séquence T2 ou FLAIR. Elles comportent idéalement, et selon la situation clinique, des séquences de perfusion et de spectroscopie. Le suivi oncologique se base sur des « IRM de référence » effectuées avant et immédiatement après chaque traitement oncologique (chirurgie, radiothérapie, chimiothérapie). Ensuite, le suivi régulier comporte une IRM tous les 3 mois pour les gliomes malins (grade III et IV) et tous les 6 mois pour un gliome diffus de bas grade (grade II). Une IRM sera systématiquement réalisée en cas de modification clinique. Évolutivité tumorale ou modifications postthérapeutiques ? La survenue d’une aggravation des anomalies de l’imagerie (augmentation des plages de prise de contraste, augmentation des plages d’hypersignal T2 ou FLAIR) dans les mois qui suivent la fin du traitement oncologique (radiothérapie, association radiothérapie et chimiothérapie) est fréquente. Quand elle se stabilise ou s’améliore sans modification du traitement oncologique, on parle de « pseudo-progression radiologique ». Les pseudo-progressions s’observent dans près de deux tiers des glioblastomes traités par un schéma de type Stupp et semblent plus fréquentes en présence d’une méthylation du gène promoteur de MGMT. À l’inverse, le traitement d’un gliome malin par anti-angiogéniques engendre des modifications radiologiques avec une diminution significative et rapide des plages de prise de contraste. Ces modifications doivent être interprétées avec prudence afin de ne pas méconnaître une « pseudoréponse radiologique » au traitement par anti-angiogéniques caractérisée par l’augmentation des plages d’hypersignal T2 ou FLAIR, signant la progression tumorale, en association à la diminution des plages de prise de contraste, donnant l’illusion d’une réponse au traitement. La mise en perspective de l’état clinique, avec les données de l’IRM multimodale et de la TEP, peuvent aider au diagnostic différentiel entre réponse au traitement, pseudo-progression, reprise évolutive du gliome et pseudoréponse. Structuration de la prise en charge neuro-oncologique des gliomes La structuration en réseaux interactifs entre les différents acteurs de la prise en charge des gliomes devient aujourd’hui nécessaire devant les constats suivants : • les gliomes sont rares ; • il existe peu de traitements standardisés et l’on constate une hétérogénéité de prise en charge sur notre territoire ; • leur diagnostic parfois difficile et la précision du bilan préthérapeutique rendent nécessaire l’emploi d’outils sophistiqués dont l’accès est restreint (IRM multimodale, biologie moléculaire, PET) ; • l’organisation actuelle rend difficile la réalisation de projets de recherche à haut niveau de preuve. Cette future structuration pourra aider à garantir les meilleurs soins aux patients, optimiser leur prise en charge, favoriser l’accès aux éventuels essais cliniques et faciliter la recherche. À l’échelon local, il convient de développer et d’ancrer des RCP dédiées à la neuro-oncologie. Des RCP multiinstitutionnelles de recours devront également être mises en place. Il existe aujourd’hui différentes initiatives régionales qui proposent des référentiels de traitement des gliomes.Dans une optique d’homogénéisation à l’échelon national de la prise en charge, un projet de rédaction de référentiels nationaux est en cours, à la demande de l’Institut national du cancer (INCa), et sous l’égide de la Société française de neurochirurgie, de l’Association des neuro-oncologues d’expression française (ANOCEF) et de la Société française de neuropathologie. Des référentiels nationaux de prise en charge des gliomes seront donc proposés en 2012. Un projet de rédaction de référentiels nationaux est en cours, à la demande de l’Institut national du cancer et sous l’égide de la Société française de neurochirurgie, de l’Association des neuro-oncologues d’expression française et de la Société française de neuropathologie. Soulignons l’existence de groupes structurés à l’échelon national qui cherchent à améliorer et homogénéiser les pratiques pour un type tumoral particulier : le projet POLA pour les oligodendrogliomes anaplasiques (grade III) et le REG (Réseau d’étude des gliomes) pour les gliomes diffus de bas grade (grade II). Ces réseaux déjà opérationnels pourront être utilement intégrés au projet de structuration nationale des tumeurs cérébrales rares en réponse à un appel d’offre en cours de l’INCa concernant l’organisation en centres experts des cancers rares de l’adulte. Points forts • Le gliome est une pathologie rare, mais sur les 30 dernières années son incidence a augmenté et la mortalité doublé. • L’IRM est une aide au diagnostic, mais ne remplace pas l’analyse histologique, seul argument de certitude. • La spectroscopie et la TEP fournissent des informations complémentaires pour le diagnostic, qui précèdent la prise de contraste. • Il existe un continuum entre les gliomes de bas grade et de haut grade de malignité. • La classification OMS souffrant d’un manque de reproductibilité, une classification élaborée à l’hôpital Sainte-Anne propose d’intégrer les données d’imagerie. • L’ajout des données moléculaires devrait renforcer la pertinence des classifications. • Les marqueurs moléculaires ont une valeur, mais le pronostic global intégre également des données cliniques, morphologiques et histologiques. • Le pronostic des gliomes reste sombre. • Il n’existe pas de traitement curateur des gliomes. • L’exérèse chirurgicale la plus complète possible est à réaliser chaque fois que possible ou à défaut, une biopsie de confirmation histologique. • Il n’existe pas de standard de traitement dans les gliomes de grade II et III. • La chimiothérapie in situ par implants peropératoires de carmustine est une option thérapeutique pour les gliomes malins. • Le suivi clinico-radiologique des gliomes est nécessaire, leur récidive étant systématique. • Écueils clinico-radiologiques des pseudo-progressions et des pseudo-réponses radiologiques. • Nécessité de structurer la prise en charge des gliomes. • Rédaction en cours de référentiels nationaux de prise en charge des gliomes.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :